Свёртывание полипептидной цепи в нативную конформацию идёт наиболее успешно в физиологических условиях. Потеря нативной конформации, денатурация, наступает при экстремальных значениях pH, высокой температуре или под действием органических растворителей, детергентов и других денатурирующих веществ.
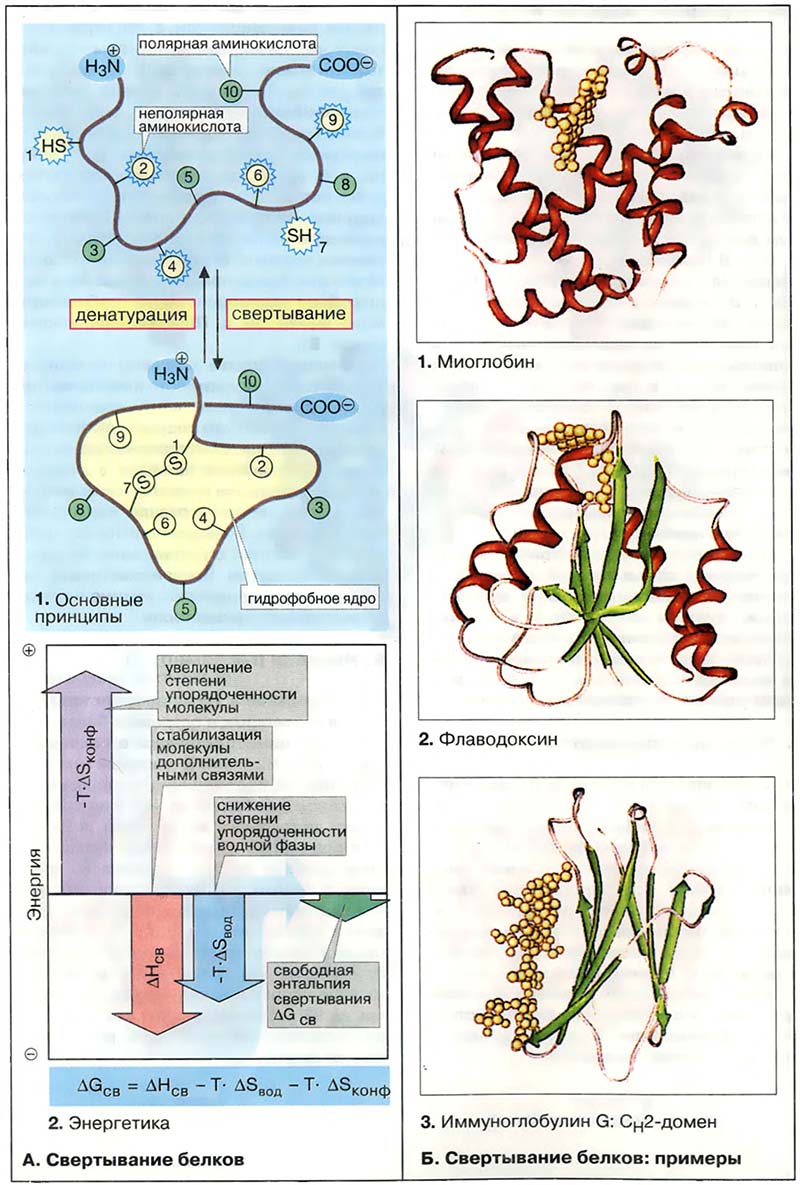
К факторам, стабилизирующим конформацию белка, относятся водородные связи, дисульфидные мостики, электростатическое взаимодействие и комплексообразование с ионами металлов (см. Метаболизм жиров). Другим очень важным стабилизирующим фактором является «гидрофобный эффект». Как отмечалось на с. Структурные белки, в смеси неполярных веществ с водой происходит разделение фаз («эффект масляных капель»), то есть идёт самопроизвольный процесс, при котором поверхность контакта между фазами стремится быть минимальной. По аналогии с этим процессом полипептидная цепь свёртывается в водной среде таким образом, чтобы как можно больше неполярных боковых групп аминокислотных остатков были бы спрятаны внутри глобулы, тогда как полярные группы контактируют с водой (1). Такой механизм позволяет объяснить распределение соответствующих группировок и в молекуле инсулина (см. Биосинтез сложных липидов).
В настоящее время не существует полного описания энергетики процесса свёртывания полипептидной цепи (2). В этом разделе обсуждается лишь предельно простая модель. В заданных условиях конформация полипептидной цепи будет устойчивой лишь в том случае, если она обладает минимумом свободной энергии (изменение свободной энергии свёртывания ΔGсв имеет знак минус) (см. Липиды). Вместе с тем свёртывание полипептидной цепи повышает степень упорядоченности белковой молекулы. А как указывалось на с. Энтальпия и энтропия, рост упорядоченности означает уменьшение энтропии системы (ΔSконф — величина отрицательная), а следовательно возрастание энтропийного члена в уравнении Гиббса—Гельмгольца (-T×ΔSконф имеет знак плюс) (фиолетовая стрелка). На процесс свёртывания также оказывают стабилизирующее воздействие ковалентные и другие типы связей, образующиеся в белковой глобуле. Поэтому изменение энтальпии свёртывания ΔHсв — величина отрицательная (красная стрелка). Другим фактором, влияющим на ход процесса, является изменение энтропии окружающей среды (воды) за счёт гидрофобного эффекта. При свёртывании полипептидной цепи снижается степень упорядоченности воды и образуется максимально возможное число водородных связей. При этом возрастает энтропия водной среды, т. е. ΔSвод — величина положительная, а следовательно, энтропийный член уравнения -Т×ΔSвод имеет знак минус (синяя стрелка). Таким образом, уменьшение энтропии полипептидной цепи перекрывается ростом энтропии окружающей среды и энтропия системы в целом возрастает. Следовательно, полипептидная цепь самопроизвольно принимает нативную конформацию, характеризующуюся минимумом свободной энергии суммарной системы (ΔGсв — величина отрицательная) (зелёная стрелка).
К факторам, стабилизирующим конформацию белка, относятся водородные связи, дисульфидные мостики, электростатическое взаимодействие и комплексообразование с ионами металлов (см. Метаболизм жиров). Другим очень важным стабилизирующим фактором является «гидрофобный эффект». Как отмечалось на с. Структурные белки, в смеси неполярных веществ с водой происходит разделение фаз («эффект масляных капель»), то есть идёт самопроизвольный процесс, при котором поверхность контакта между фазами стремится быть минимальной. По аналогии с этим процессом полипептидная цепь свёртывается в водной среде таким образом, чтобы как можно больше неполярных боковых групп аминокислотных остатков были бы спрятаны внутри глобулы, тогда как полярные группы контактируют с водой (1). Такой механизм позволяет объяснить распределение соответствующих группировок и в молекуле инсулина (см. Биосинтез сложных липидов).
В настоящее время не существует полного описания энергетики процесса свёртывания полипептидной цепи (2). В этом разделе обсуждается лишь предельно простая модель. В заданных условиях конформация полипептидной цепи будет устойчивой лишь в том случае, если она обладает минимумом свободной энергии (изменение свободной энергии свёртывания ΔGсв имеет знак минус) (см. Липиды). Вместе с тем свёртывание полипептидной цепи повышает степень упорядоченности белковой молекулы. А как указывалось на с. Энтальпия и энтропия, рост упорядоченности означает уменьшение энтропии системы (ΔSконф — величина отрицательная), а следовательно возрастание энтропийного члена в уравнении Гиббса—Гельмгольца (-T×ΔSконф имеет знак плюс) (фиолетовая стрелка). На процесс свёртывания также оказывают стабилизирующее воздействие ковалентные и другие типы связей, образующиеся в белковой глобуле. Поэтому изменение энтальпии свёртывания ΔHсв — величина отрицательная (красная стрелка). Другим фактором, влияющим на ход процесса, является изменение энтропии окружающей среды (воды) за счёт гидрофобного эффекта. При свёртывании полипептидной цепи снижается степень упорядоченности воды и образуется максимально возможное число водородных связей. При этом возрастает энтропия водной среды, т. е. ΔSвод — величина положительная, а следовательно, энтропийный член уравнения -Т×ΔSвод имеет знак минус (синяя стрелка). Таким образом, уменьшение энтропии полипептидной цепи перекрывается ростом энтропии окружающей среды и энтропия системы в целом возрастает. Следовательно, полипептидная цепь самопроизвольно принимает нативную конформацию, характеризующуюся минимумом свободной энергии суммарной системы (ΔGсв — величина отрицательная) (зелёная стрелка).
Статьи раздела «Свёртывание белков»:
- Свёртывание белков
- А. Свёртывание белков
- Б. Свёртывание белков: примеры
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation
Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation A novel role of TCF family in body axis formation. Revolutionary high impact discoveries are described, elucidating the missing link in the Wnt ...
 Введение в молекулярную биологию
Введение в молекулярную биологию Книга представляет собой переработанный курс лекций, который авторы читают ...
 Математические модели морфогенеза
Математические модели морфогенеза Автором предлагаемого курса лекций по математическим моделям морфогенеза ...
Исследования, проводимые на микроорганизмах, внесли немалый вклад в изучение ...