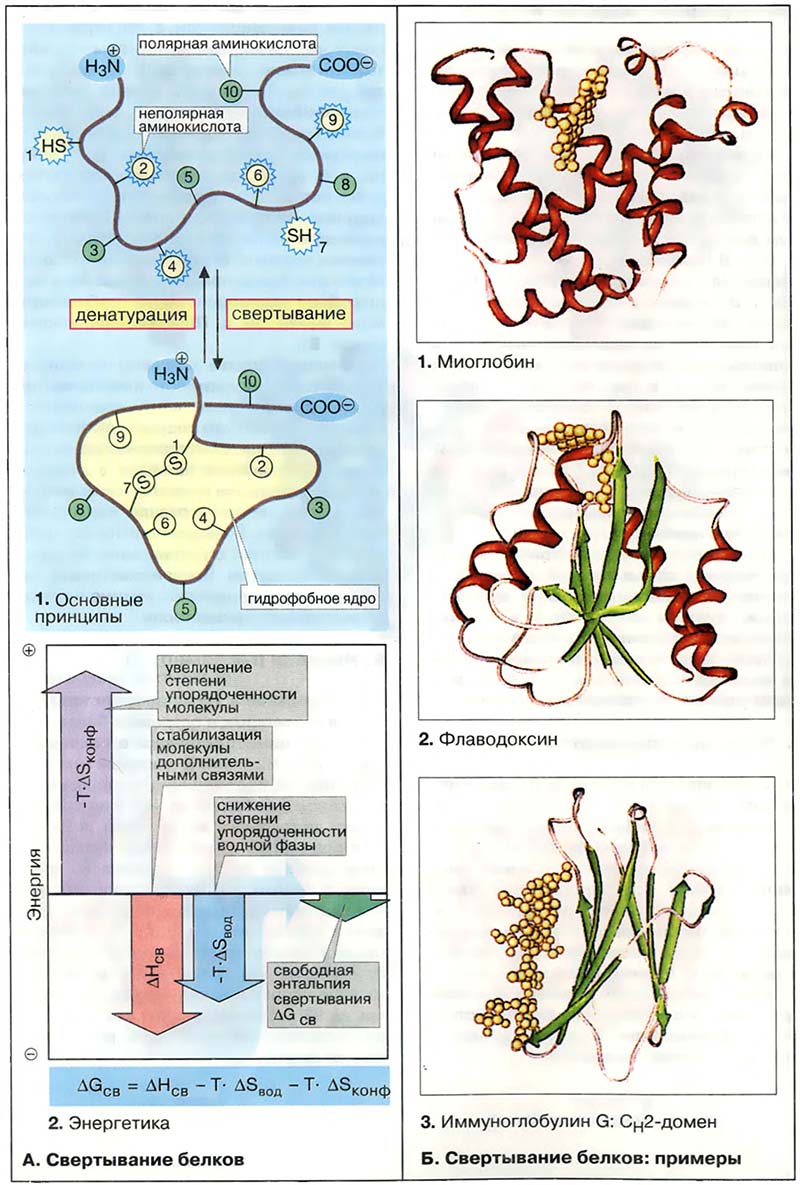
Информация относительно биологически активной (нативной) конформации полипептидной цепи закодирована в аминокислотной последовательности. Вторичные, третичные и четвертичные структуры многих белков образуются в растворе самопроизвольно в пределах нескольких минут. Тем не менее в клетке имеются специальные белки (шапероны, см. Транслокация белков. Шапероны), функция которых обеспечивать свёртывание полипептидных цепей вновь синтезируемых белков. Выяснение закономерностей свёртывания полипептидных цепей является одной из важнейших задач биохимии. В случае успеха появилась бы возможность предсказывать нативные конформации белков на основании данных об аминокислотных последовательностях, реконструируемых на основании относительно легко доступных ДНК-последовательностей (см. Секвенирование ДНК).
Статьи раздела «Свёртывание белков»:
- Свёртывание белков
- А. Свёртывание белков
- Б. Свёртывание белков: примеры
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Фотосинтез. В 2 томах (комплект)
Фотосинтез. В 2 томах (комплект) Книга, написанная в основном американскими авторами, представляет собой ...
 Паразитические нематоды растений и насекомых
Паразитические нематоды растений и насекомых В книге представлены обобщающие работы по современным теоретическим и ...
Книга посвящена ряду актуальных проблем молекулярной биологии (молекулярный ...