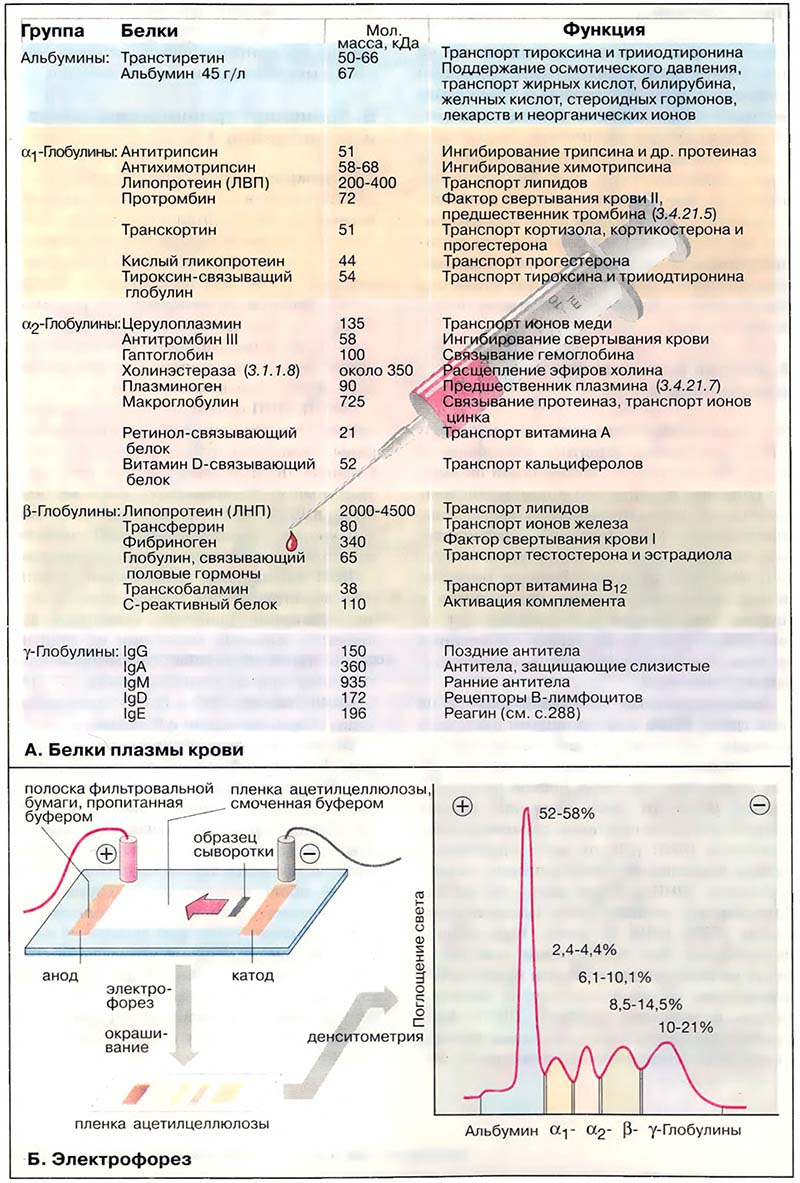
В плазме крови человека содержится около 100 различных белков. По подвижности при электрофорезе их можно грубо разделить на пять фракций: альбумин, α1-, α2-, β-, γ-глобулины. Разделение на альбумин и глобулин первоначально основывалось на различии в растворимости: альбумины растворимы в чистой воде, а глобулины — только в присутствии солей.
В количественном отношении среди белков плазмы наиболее представлен альбумин (около 45 г/л), который играет существенную роль в поддержании коллоидно-осмотического давления в крови и служит для организма важным резервом аминокислот. Альбумин обладает способностью связывать липофильные вещества, вследствие чего он может функционировать в качестве белка-переносчика длинноцепочечных жирных кислот, билирубина, лекарственных веществ, некоторых стероидных гормонов и витаминов. Кроме того, альбумин связывает ионы Ca2+ и Mg2+.
К альбуминовой фракции принадлежит также транстиретин (преальбумин), который вместе с тироксин-связывающим глобулином [ТСГл (TBG)] и альбумином транспортирует гормон тироксин и его метаболит йод-тиронин.
В таблице приведены другие свойства важных глобулинов плазмы крови. Эти белки участвуют в транспорте липидов (см. Липопротеины), гормонов, витаминов и ионов металлов, они образуют важные компоненты системы свёртывания крови (см. Свёртывание крови); фракция γ-глобулинов содержит антитела иммунной системы (см. Антитела).
Образование и разрушение. Большинство белков плазмы синтезируется в клетках печени. Исключение составляют иммуноглобулины, которые продуцируются плазматическими клетками иммунной системы (см. Иммунный ответ), и пептидные гормоны, секретируемые клетками эндокринных желез (см. Метаболизм пептидных гормонов). Кроме альбумина почти все белки плазмы являются гликопротеинами. Они включают олигосахариды, присоединённые к аминокислотным остаткам N- и О-гликозидными связями (см. Окислительно-восстановительные коферменты). В качестве концевого остатка углеводной цепи часто выступает N-ацетилнейраминовая кислота (сиаловая кислота, см. Ферментативный катализ). Если эта группа отщепляется нейраминидазой, ферментом находящимся в стенках кровеносных сосудов, на поверхности белка оказываются концевые остатки галактозы. Остатки галактозы асиалогликопротеинов (то есть десиалированных белков) узнаются и связываются рецепторами галактозы на гепатоцитах. В печени эти «состарившиеся» белки плазмы удаляются путём эндоцитоза. Таким образом, олигосахариды на поверхности белка определяют время жизни белков плазмы, полупериод выведения (биохимический полупериод) которых составляет от нескольких дней до нескольких недель (см. Метаболизм стероидных гормонов).
В здоровом организме концентрация белков плазмы поддерживается на постоянном уровне. Однако их концентрация изменяется при заболевании органов, участвующих в синтезе и катаболизме этих белков. Повреждение тканей посредством цитокинов (см. Цитокины) увеличивает образование белков острой фазы, к которым принадлежат C-ре-активный белок, гаптоглобин, фибриноген, компонент C-3 комплемента и некоторые другие.
В количественном отношении среди белков плазмы наиболее представлен альбумин (около 45 г/л), который играет существенную роль в поддержании коллоидно-осмотического давления в крови и служит для организма важным резервом аминокислот. Альбумин обладает способностью связывать липофильные вещества, вследствие чего он может функционировать в качестве белка-переносчика длинноцепочечных жирных кислот, билирубина, лекарственных веществ, некоторых стероидных гормонов и витаминов. Кроме того, альбумин связывает ионы Ca2+ и Mg2+.
К альбуминовой фракции принадлежит также транстиретин (преальбумин), который вместе с тироксин-связывающим глобулином [ТСГл (TBG)] и альбумином транспортирует гормон тироксин и его метаболит йод-тиронин.
В таблице приведены другие свойства важных глобулинов плазмы крови. Эти белки участвуют в транспорте липидов (см. Липопротеины), гормонов, витаминов и ионов металлов, они образуют важные компоненты системы свёртывания крови (см. Свёртывание крови); фракция γ-глобулинов содержит антитела иммунной системы (см. Антитела).
Образование и разрушение. Большинство белков плазмы синтезируется в клетках печени. Исключение составляют иммуноглобулины, которые продуцируются плазматическими клетками иммунной системы (см. Иммунный ответ), и пептидные гормоны, секретируемые клетками эндокринных желез (см. Метаболизм пептидных гормонов). Кроме альбумина почти все белки плазмы являются гликопротеинами. Они включают олигосахариды, присоединённые к аминокислотным остаткам N- и О-гликозидными связями (см. Окислительно-восстановительные коферменты). В качестве концевого остатка углеводной цепи часто выступает N-ацетилнейраминовая кислота (сиаловая кислота, см. Ферментативный катализ). Если эта группа отщепляется нейраминидазой, ферментом находящимся в стенках кровеносных сосудов, на поверхности белка оказываются концевые остатки галактозы. Остатки галактозы асиалогликопротеинов (то есть десиалированных белков) узнаются и связываются рецепторами галактозы на гепатоцитах. В печени эти «состарившиеся» белки плазмы удаляются путём эндоцитоза. Таким образом, олигосахариды на поверхности белка определяют время жизни белков плазмы, полупериод выведения (биохимический полупериод) которых составляет от нескольких дней до нескольких недель (см. Метаболизм стероидных гормонов).
В здоровом организме концентрация белков плазмы поддерживается на постоянном уровне. Однако их концентрация изменяется при заболевании органов, участвующих в синтезе и катаболизме этих белков. Повреждение тканей посредством цитокинов (см. Цитокины) увеличивает образование белков острой фазы, к которым принадлежат C-ре-активный белок, гаптоглобин, фибриноген, компонент C-3 комплемента и некоторые другие.
Статьи раздела «Белки плазмы крови»:
- Белки плазмы крови
- А. Белки плазмы крови
- Б. Электрофорез
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Principles of Biomedical Informatics
Principles of Biomedical Informatics Biomedical informatics (BMI) is an extraordinarily broad discipline. In scale, it spans across genes, cells, tissues, organ systems, individual ...
 Защита от биоповреждений, вызываемых грибами
Защита от биоповреждений, вызываемых грибами Книга посвящена проблеме снижения химической и биологической опасности в сфере ...
 How to Build a Dinosaur: The New Science of Reverse Evolution
How to Build a Dinosaur: The New Science of Reverse Evolution A world-renowned paleontologist reveals groundbreaking science that trumps science fiction: how to grow a living dinosaur Over a decade after Jurassic ...
 Объекты биологии развития
Объекты биологии развития Монография представляет собой вторую книгу из серии «Проблемы биологии ...