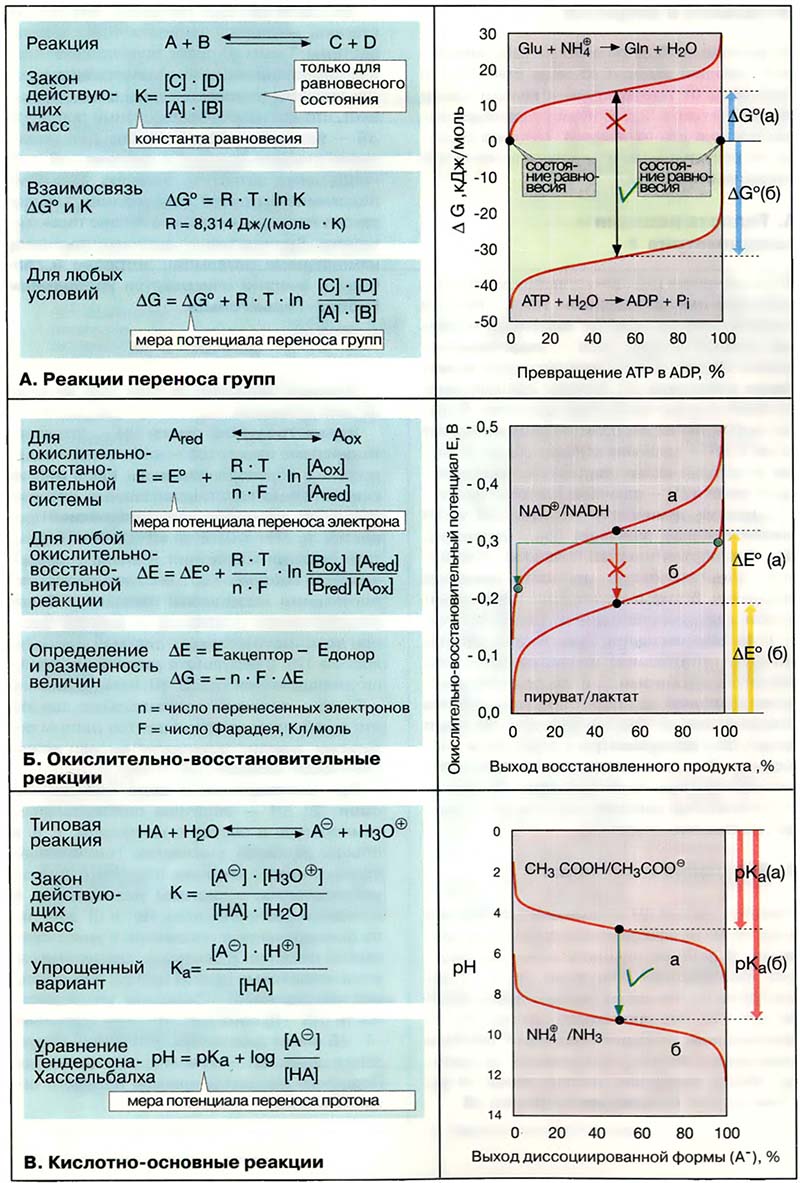
Каждая химическая реакция по истечении некоторого времени достигает состояния равновесия, при котором прямая и обратная реакции идут с равными скоростями. Соотношение концентраций исходных веществ (A, B) и конечных продуктов (C, D) в равновесном состоянии описываются законом действующих масс. Константа равновесия К непосредственно связана с изменением свободной энергии реакции в стандартных условиях ΔG° (ΔG° = -RTln К). Уравнение действительно для любых концентраций веществ. Если ΔG меньше 0, реакция протекает спонтанно до тех пор, пока не будет достигнуто равновесие (т. е. до ΔG° = 0). При ΔG больше 0 реакция не может протекать спонтанно (эндергонический процесс, см. Липиды). В биохимии ΔG обычно относят к pH 7 и обозначают как ΔG°’ или ΔG’.
В качестве примера на схеме приводятся две реакции переноса групп. Перенос фосфатных групп от аденозинтрифосфата [АТФ(АТР)] к воде — высоко экзергонический процесс [реакция (а)]. Равновесие наступает лишь при гидролизе более 99,9% исходного АТФ (см. Секвенирование ДНК). АТФ и родственные соединения являются высокоэффективными переносчиками фосфатных групп. Количественно это свойство выражается величинами свободной энергии реакции гидролиза ΔG°.
Напротив, эндергонический процесс — перенос аммиака (NH3) на глутамат [Glu, реакция (б)] — достигает равновесия настолько быстро, что за это время успевает образоваться минимальное количество глутамина. Поэтому синтез глутамина из названных предшественников возможен лишь при сопряжении с экзергонической реакцией (см. Энергетическое сопряжение).
В качестве примера на схеме приводятся две реакции переноса групп. Перенос фосфатных групп от аденозинтрифосфата [АТФ(АТР)] к воде — высоко экзергонический процесс [реакция (а)]. Равновесие наступает лишь при гидролизе более 99,9% исходного АТФ (см. Секвенирование ДНК). АТФ и родственные соединения являются высокоэффективными переносчиками фосфатных групп. Количественно это свойство выражается величинами свободной энергии реакции гидролиза ΔG°.
Напротив, эндергонический процесс — перенос аммиака (NH3) на глутамат [Glu, реакция (б)] — достигает равновесия настолько быстро, что за это время успевает образоваться минимальное количество глутамина. Поэтому синтез глутамина из названных предшественников возможен лишь при сопряжении с экзергонической реакцией (см. Энергетическое сопряжение).
Статьи раздела «Равновесие»:
- А. Реакции переноса групп
- Б. Окислительно-восстановительные реакции
- В. Кислотно-основные реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Физика белка. Курс лекций с цветными и стереоскопическими иллюстрациями и задачами
Физика белка. Курс лекций с цветными и стереоскопическими иллюстрациями и задачами Физика белка простирается от классификации и принципов устройства белков ...
 Review of Medical Microbiology and Immunology
Review of Medical Microbiology and Immunology To put your preparation for USMLE Step 1 and course exams on the fast track, only one resource will do: «Review of Medical Microbiology and ...
 Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology
Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology Synthesizing over thirty years of advances into a comprehensive textbook, Biomolecular Crystallography describes the fundamentals, practices, and ...