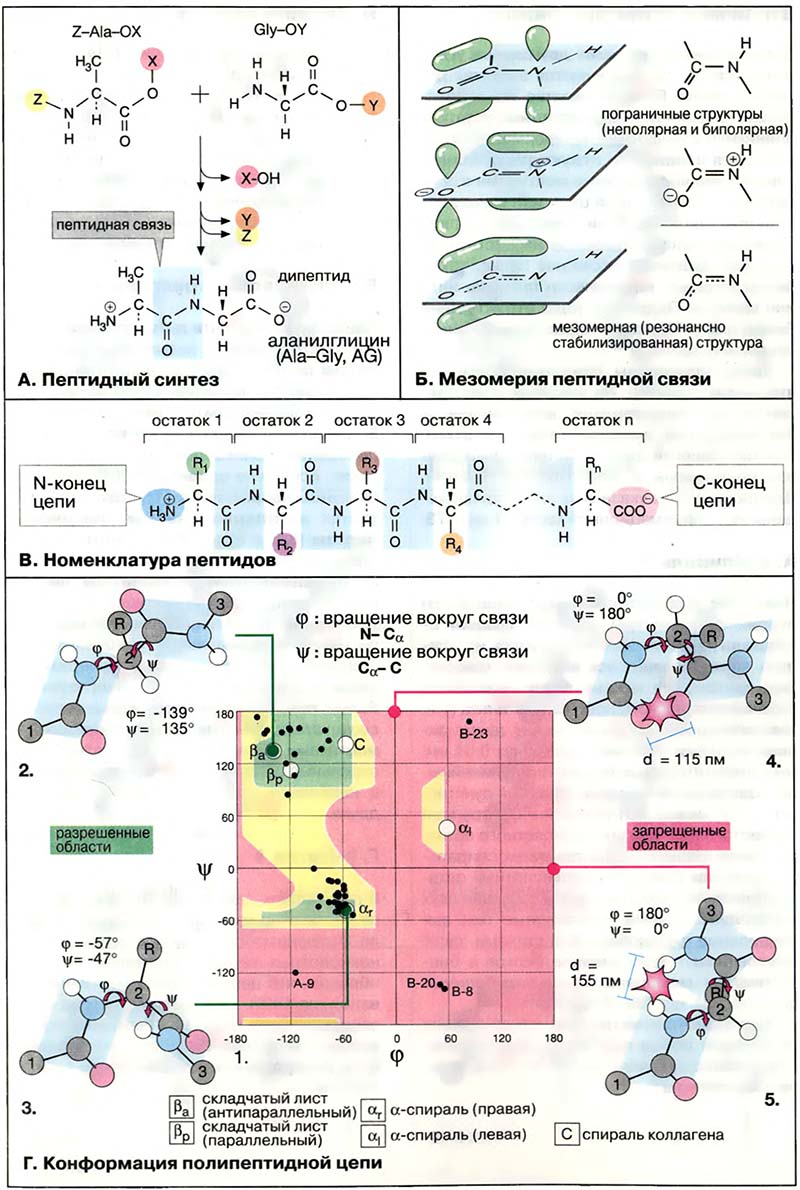
Каждый аминокислотный остаток, за исключением концевых, принимает участие в образовании двух пептидных связей (с предыдущим и последующим фрагментами). Поскольку вращение вокруг связи C-N затруднено, повороты возможны только вокруг связей N—Cα, и Cα—C (2). Такие повороты измеряются двугранными углами φ и ψ. Угол φ характеризует поворот вокруг связи N—Cα, а следовательно, положение предшествующей пептидной связи; угол ψ характеризует поворот вокруг связи Сα—C, то есть положение последующей связи.
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определённые комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты (1). На карте видно, что большинство комбинаций двугранных углов оказываются запрещёнными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0°/ψ = 180° (4) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180°/ψ = 0° (5) происходит наложение водородных атомов двух NH-групп. Поэтому для углов φ и ψ остаются разрешёнными сочетания, лежащие в пределах дискретных областей, окрашенных в зелёный цвет (2, 3). В эти разрешённые области попадают все приведённые на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные жёлтым цветом, энергетически невыгодны, но возможны.
Конформационные карты (карты Рамачандрана) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешённые области карты. На карте 1 чёрными точками показаны пары углов φ и ψ в небольшом белке инсулине (см. Глобулярные белки).
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определённые комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты (1). На карте видно, что большинство комбинаций двугранных углов оказываются запрещёнными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0°/ψ = 180° (4) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180°/ψ = 0° (5) происходит наложение водородных атомов двух NH-групп. Поэтому для углов φ и ψ остаются разрешёнными сочетания, лежащие в пределах дискретных областей, окрашенных в зелёный цвет (2, 3). В эти разрешённые области попадают все приведённые на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные жёлтым цветом, энергетически невыгодны, но возможны.
Конформационные карты (карты Рамачандрана) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешённые области карты. На карте 1 чёрными точками показаны пары углов φ и ψ в небольшом белке инсулине (см. Глобулярные белки).
Статьи раздела «Пептидная связь»:
- Пептидная связь
- A. Пептидный синтез
- Б. Мезомерия пептидной связи
- B. Номенклатура пептидов
- Г. Конформация полипептидной цепи
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition)
Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition) The Third Edition of Microbiology with Diseases by Taxonomy is the most cutting-edge microbiology book available, offering unparalleled currency, ...
 Molecular Biology of the Cell: The Problems Book
Molecular Biology of the Cell: The Problems Book The Problems Book helps students appreciate the ways in which experiments and simple calculations can lead to an understanding of how cells work by ...