Большая группа протеиназ содержит в активном центре серин. К сериновым протеиназам принадлежат, например, ферменты пищеварения трипсин, химотрипсин и эластаза (см. Секреты пищеварительного тракта), многие факторы свертывания крови (см. Свёртывание крови), а также фибринолитический фермент плазмин и его активаторы (см. Фибринолиз. Группы крови).
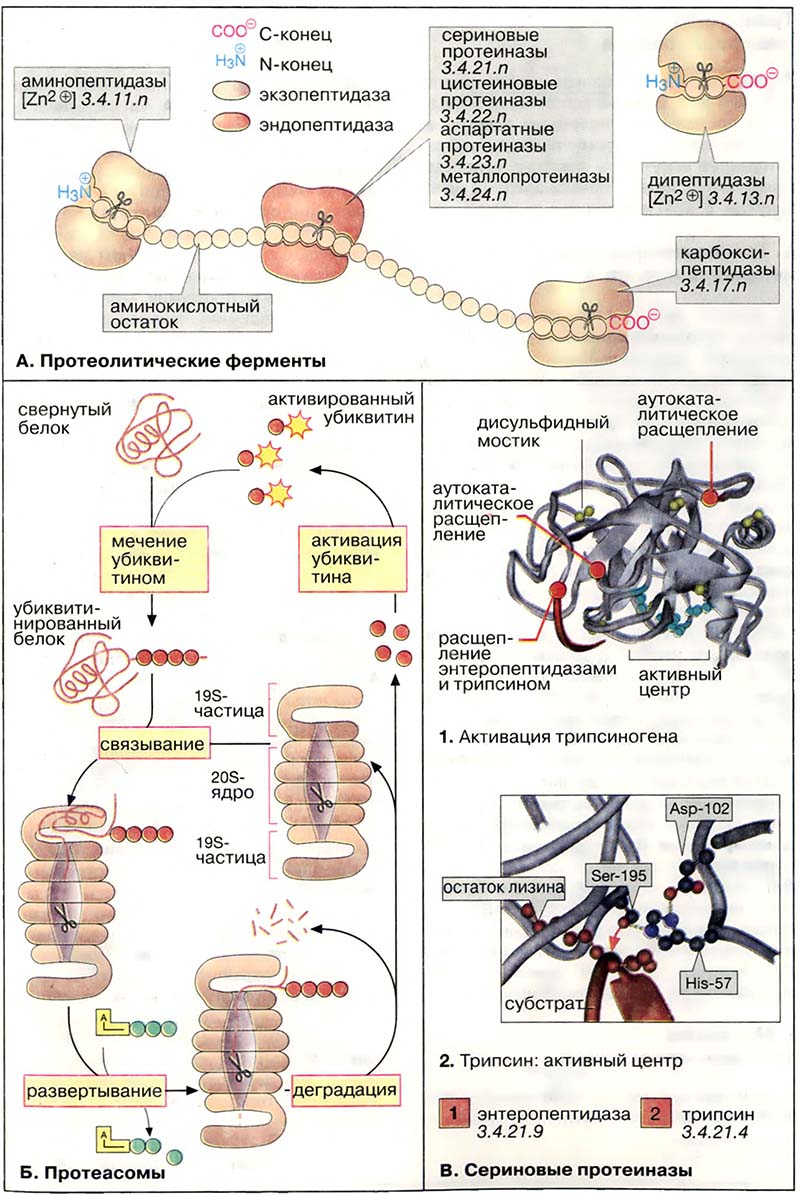
Как показано в статье Процессы пищеварения, панкреатические протеиназы секретируются в виде проферментов (зимогенов). Активация таких ферментов основана на протеолитическом расщеплении. Процесс активации показан на примере трипсиногена, предшественника трипсина (1). Она начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»), специфической сериновой протеиназой, которая локализована в мембранах кишечного эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом (аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы A и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2. Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата расположена в С-концевой стороне от остатка лизина, боковая цепь которого во время катализа фиксируется в специальном «кармане» фермента (на схеме слева).
Как показано в статье Процессы пищеварения, панкреатические протеиназы секретируются в виде проферментов (зимогенов). Активация таких ферментов основана на протеолитическом расщеплении. Процесс активации показан на примере трипсиногена, предшественника трипсина (1). Она начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»), специфической сериновой протеиназой, которая локализована в мембранах кишечного эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом (аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы A и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2. Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата расположена в С-концевой стороне от остатка лизина, боковая цепь которого во время катализа фиксируется в специальном «кармане» фермента (на схеме слева).
Статьи раздела «Протеолиз»:
- А. Протеолитические ферменты
- Б. Протеасомы
- В. Сериновые протеиназы
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Лекции по природоведческой микробиологии
Лекции по природоведческой микробиологии Книга основана на курсе лекций, прочитанных в МГУ им. М. В. Ломоносова в 1995-2002 гг. ...
 Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology
Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology Synthesizing over thirty years of advances into a comprehensive textbook, Biomolecular Crystallography describes the fundamentals, practices, and ...
 Современные успехи химии и биологии моря
Современные успехи химии и биологии моря Книга Харвея, содержащая много фактического материала и интересных выводов, ...
Исследования, проводимые на микроорганизмах, внесли немалый вклад в изучение ...