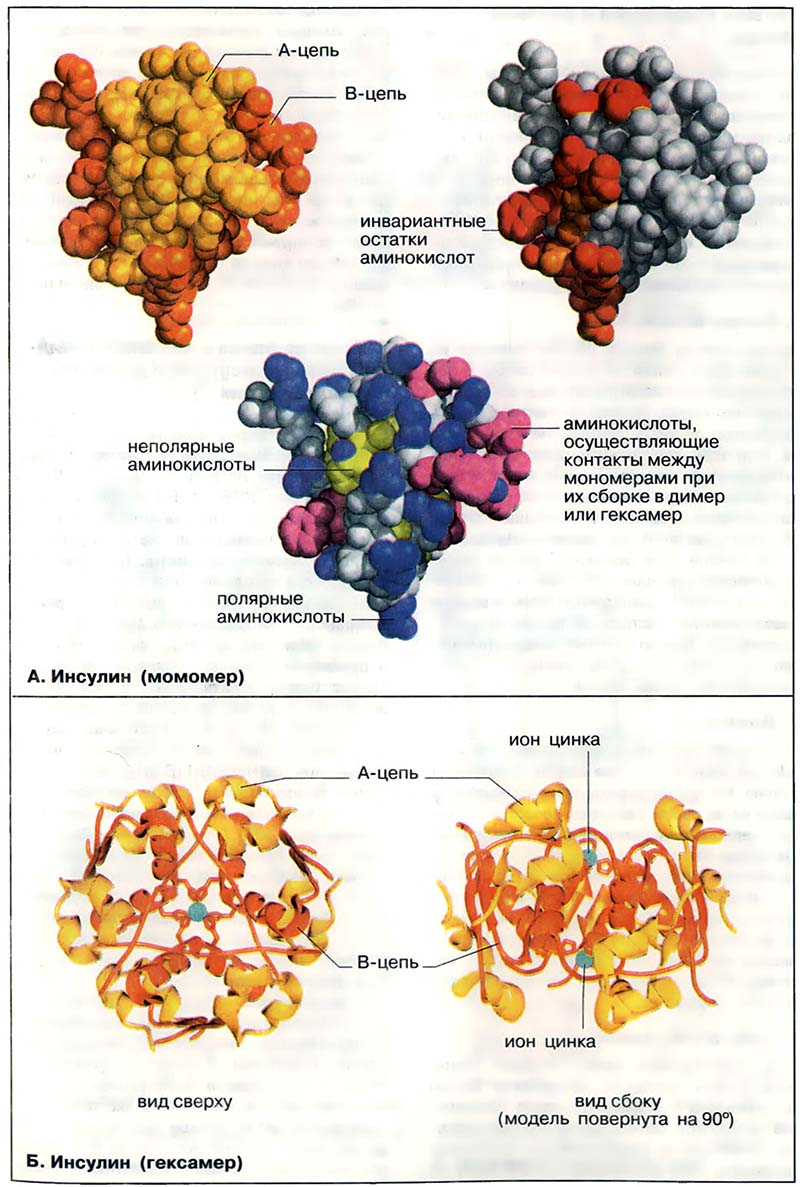
Мономер инсулина состоит из 51 аминокислотного остатка (см. Метаболизм жиров), т. е. по молекулярной массе (5,5 кДа) он вдвое уступает самому низкомолекулярному ферменту. Тем не менее инсулин остаётся типичным глобулярным белком. В растворе инсулин имеет четвертичную структуру, которая существенна для его сигнальной функции. На приведённой слева вандерваапьсовой модели A-цепь окрашена в жёлтый цвет, а B-цепь — в оранжевый. Известно, что молекула имеет клинообразную форму. Острие клина сформировано B-цепью, которая в этом месте меняет направление.
На модели (в центре) боковые группы полярных аминокислот (см. Цитратный цикл: метаболические функции) окрашены в синий цвет, а неполярные группы — в жёлтый или красно-фиолетовый. Это сделано с тем, чтобы подчеркнуть важное значение гидрофобного эффекта в свёртывании белков (см. Свёртывание белков). Большинство гидрофобных боковых цепей находится внутри глобулы, в то время как гидрофильные группировки остаются на поверхности. Этому правилу явно противоречит присутствие на поверхности неполярных боковых групп (окрашены в красно-фиолетовый цвет). Однако все эти группы принимают участие в гидрофобных взаимодействиях, стабилизирующих димер и гексамер инсулина (см. Б).
На модели справа выделены остатки, которые лежат на поверхности и инвариантны (красный цвет) или почти инвариантны (оранжевый цвет) для инсулина любого происхождения. При этом принималось во внимание, что наиболее важными в функциональном отношении являются аминокислотные остатки, не претерпевшие изменений в ходе эволюции. В инсулине почти все инвариантные остатки сгруппированы на одной стороне молекулы. Предположительно, эти аминокислоты принимают участие в связывании гормона с рецептором.
На модели (в центре) боковые группы полярных аминокислот (см. Цитратный цикл: метаболические функции) окрашены в синий цвет, а неполярные группы — в жёлтый или красно-фиолетовый. Это сделано с тем, чтобы подчеркнуть важное значение гидрофобного эффекта в свёртывании белков (см. Свёртывание белков). Большинство гидрофобных боковых цепей находится внутри глобулы, в то время как гидрофильные группировки остаются на поверхности. Этому правилу явно противоречит присутствие на поверхности неполярных боковых групп (окрашены в красно-фиолетовый цвет). Однако все эти группы принимают участие в гидрофобных взаимодействиях, стабилизирующих димер и гексамер инсулина (см. Б).
На модели справа выделены остатки, которые лежат на поверхности и инвариантны (красный цвет) или почти инвариантны (оранжевый цвет) для инсулина любого происхождения. При этом принималось во внимание, что наиболее важными в функциональном отношении являются аминокислотные остатки, не претерпевшие изменений в ходе эволюции. В инсулине почти все инвариантные остатки сгруппированы на одной стороне молекулы. Предположительно, эти аминокислоты принимают участие в связывании гормона с рецептором.
Статьи раздела «Молекулярные модели: инсулин»:
- Молекулярные модели: инсулин
- А. Инсулин (мономер)
- Б. Инсулин (гексамер)
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Исследования, проводимые на микроорганизмах, внесли немалый вклад в изучение ...
 Защита от биоповреждений, вызываемых грибами
Защита от биоповреждений, вызываемых грибами Книга посвящена проблеме снижения химической и биологической опасности в сфере ...
 Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation
Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation A novel role of TCF family in body axis formation. Revolutionary high impact discoveries are described, elucidating the missing link in the Wnt ...