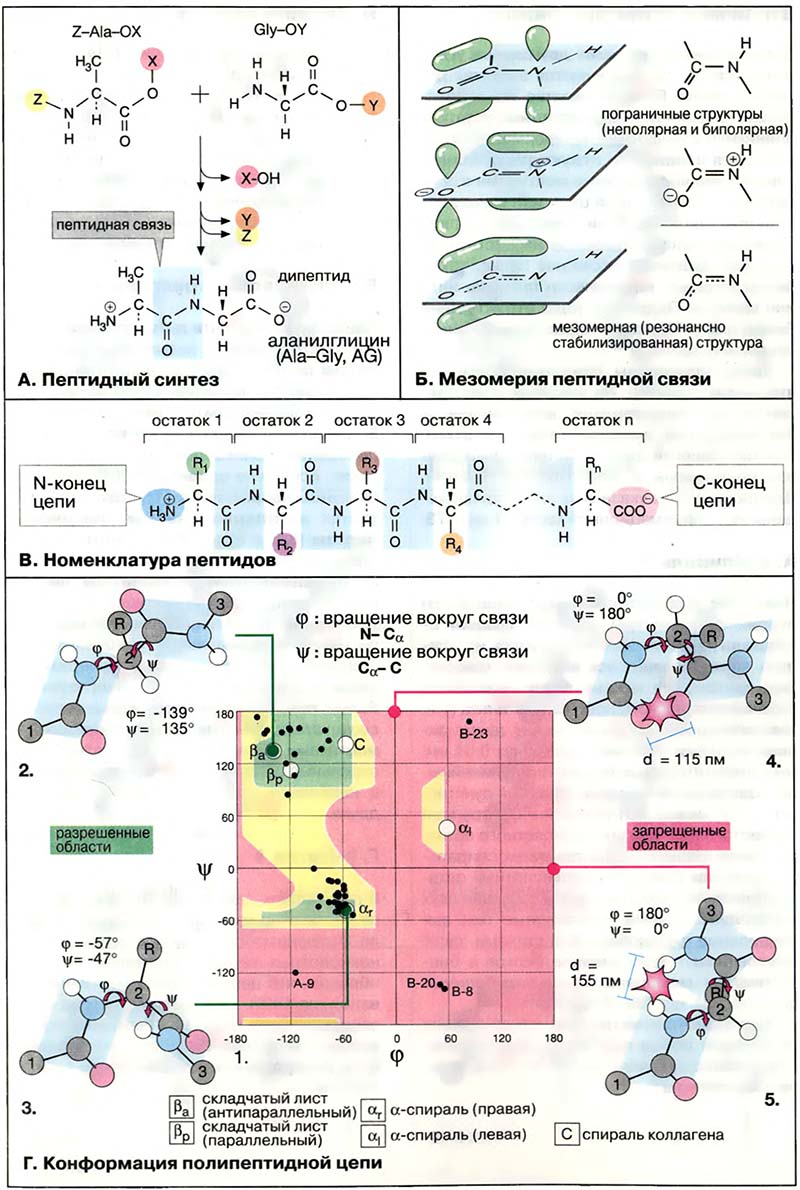
Каждый аминокислотный остаток, за исключением концевых, принимает участие в образовании двух пептидных связей (с предыдущим и последующим фрагментами). Поскольку вращение вокруг связи C-N затруднено, повороты возможны только вокруг связей N—Cα, и Cα—C (2). Такие повороты измеряются двугранными углами φ и ψ. Угол φ характеризует поворот вокруг связи N—Cα, а следовательно, положение предшествующей пептидной связи; угол ψ характеризует поворот вокруг связи Сα—C, то есть положение последующей связи.
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определённые комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты (1). На карте видно, что большинство комбинаций двугранных углов оказываются запрещёнными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0°/ψ = 180° (4) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180°/ψ = 0° (5) происходит наложение водородных атомов двух NH-групп. Поэтому для углов φ и ψ остаются разрешёнными сочетания, лежащие в пределах дискретных областей, окрашенных в зелёный цвет (2, 3). В эти разрешённые области попадают все приведённые на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные жёлтым цветом, энергетически невыгодны, но возможны.
Конформационные карты (карты Рамачандрана) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешённые области карты. На карте 1 чёрными точками показаны пары углов φ и ψ в небольшом белке инсулине (см. Глобулярные белки).
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определённые комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты (1). На карте видно, что большинство комбинаций двугранных углов оказываются запрещёнными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0°/ψ = 180° (4) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180°/ψ = 0° (5) происходит наложение водородных атомов двух NH-групп. Поэтому для углов φ и ψ остаются разрешёнными сочетания, лежащие в пределах дискретных областей, окрашенных в зелёный цвет (2, 3). В эти разрешённые области попадают все приведённые на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные жёлтым цветом, энергетически невыгодны, но возможны.
Конформационные карты (карты Рамачандрана) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешённые области карты. На карте 1 чёрными точками показаны пары углов φ и ψ в небольшом белке инсулине (см. Глобулярные белки).
Статьи раздела «Пептидная связь»:
- Пептидная связь
- A. Пептидный синтез
- Б. Мезомерия пептидной связи
- B. Номенклатура пептидов
- Г. Конформация полипептидной цепи
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Учебник состоит из четырёх частей, включающих 15 глав, в которых изложены вопросы ...
 Интеллектуальные липидные наноконтейнеры в адресной доставке лекарственных веществ
Интеллектуальные липидные наноконтейнеры в адресной доставке лекарственных веществ Настоящая книга рассказывает о новейших достижениях в использовании липидов и ...
 Ультразвук. Физико-химическое и биологическое действие
Ультразвук. Физико-химическое и биологическое действие Монография посвящена одной из актуальнейших проблем современной биофизики — ...
 The Reef Aquarium: Science, Art, and Technology, Vol. 3
The Reef Aquarium: Science, Art, and Technology, Vol. 3 The Reef Aquarium Volume Three: Science, Art, and Technology Reefkeeping science involves the interplay of biology, chemistry, and physics. However, a ...