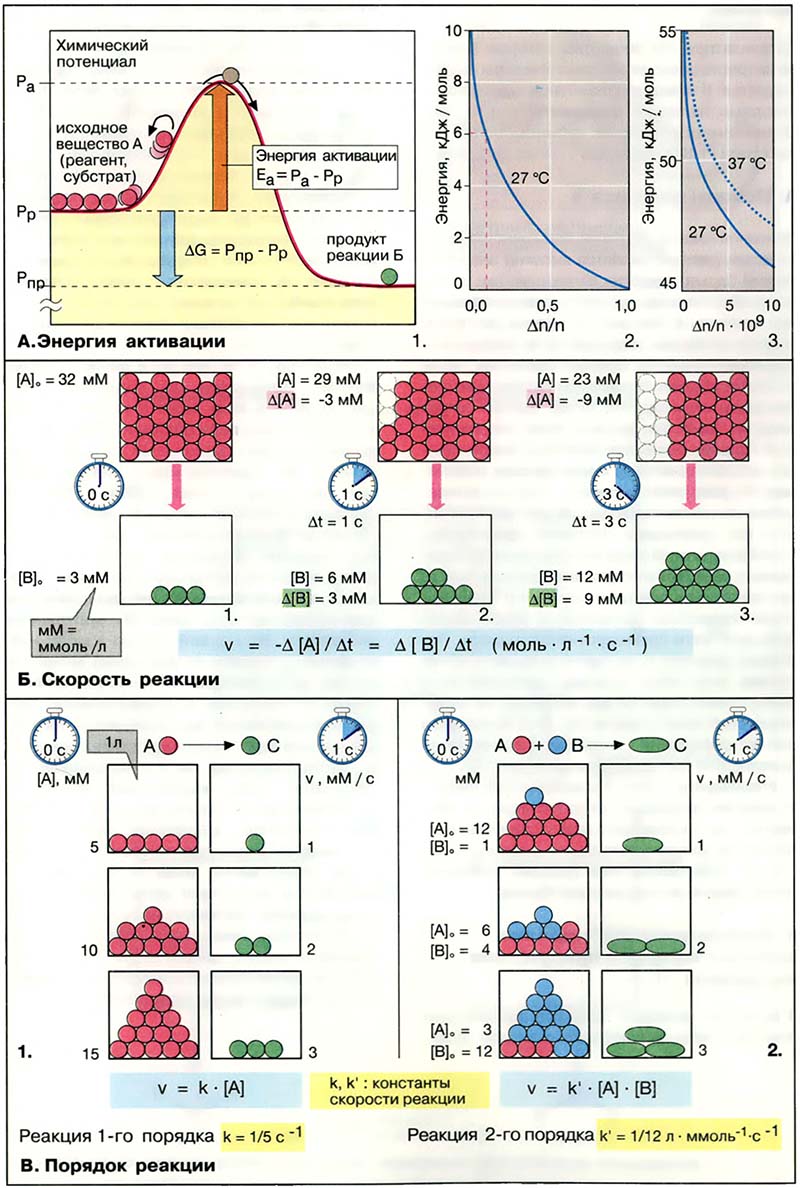
Скорость реакции зависит не только от энергии активации и температуры, но и от концентрации реагентов. Если имеется лишь один субстрат A (1), то скорость v прямо пропорциональна концентрации [A]; это реакция первого порядка. Если в реакции участвуют два реагента A и B (2), то речь идёт о реакции второго порядка . В таком случае v пропорциональна произведению концентрации реагентов. Коэффициенты k и k’ — константы скорости реакции — зависят от типа реакции и условий её проведения.
На схеме Б приведена кинетика простых необратимых реакций. Обратимые или многоступенчатые реакции могут быть разделены на промежуточные реакции первого или второго порядка и описаны с помощью соответствующих уравнений (см. кинетика Михаэлиса-Ментен, с. Кинетика ферментативных реакций).
На схеме Б приведена кинетика простых необратимых реакций. Обратимые или многоступенчатые реакции могут быть разделены на промежуточные реакции первого или второго порядка и описаны с помощью соответствующих уравнений (см. кинетика Михаэлиса-Ментен, с. Кинетика ферментативных реакций).
Статьи раздела «Кинетика химических реакций»:
- Кинетика химических реакций
- А. Энергия активации
- Б. Скорость реакции
- В. Порядок реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Москва, 1955 год. Академия наук СССР. Издательский переплёт. Сохранность хорошая. На ...
 Структура и стабильность биологических макромолекул
Структура и стабильность биологических макромолекул В книге рассмотрены строение и свойства биополимеров — в основном белков. Такие ...
 Влияние тяжелых металлов на процессы биохимического окисления органических веществ
Влияние тяжелых металлов на процессы биохимического окисления органических веществ В научной монографии рассмотрены основные направления очистки сточных вод, ...
 Методы в молекулярной биофизике. Структура. Функция. Динамика. В 2 томах. Том 2
Методы в молекулярной биофизике. Структура. Функция. Динамика. В 2 томах. Том 2 Учебное пособие посвящено современному описанию физико-химических подходов, ...