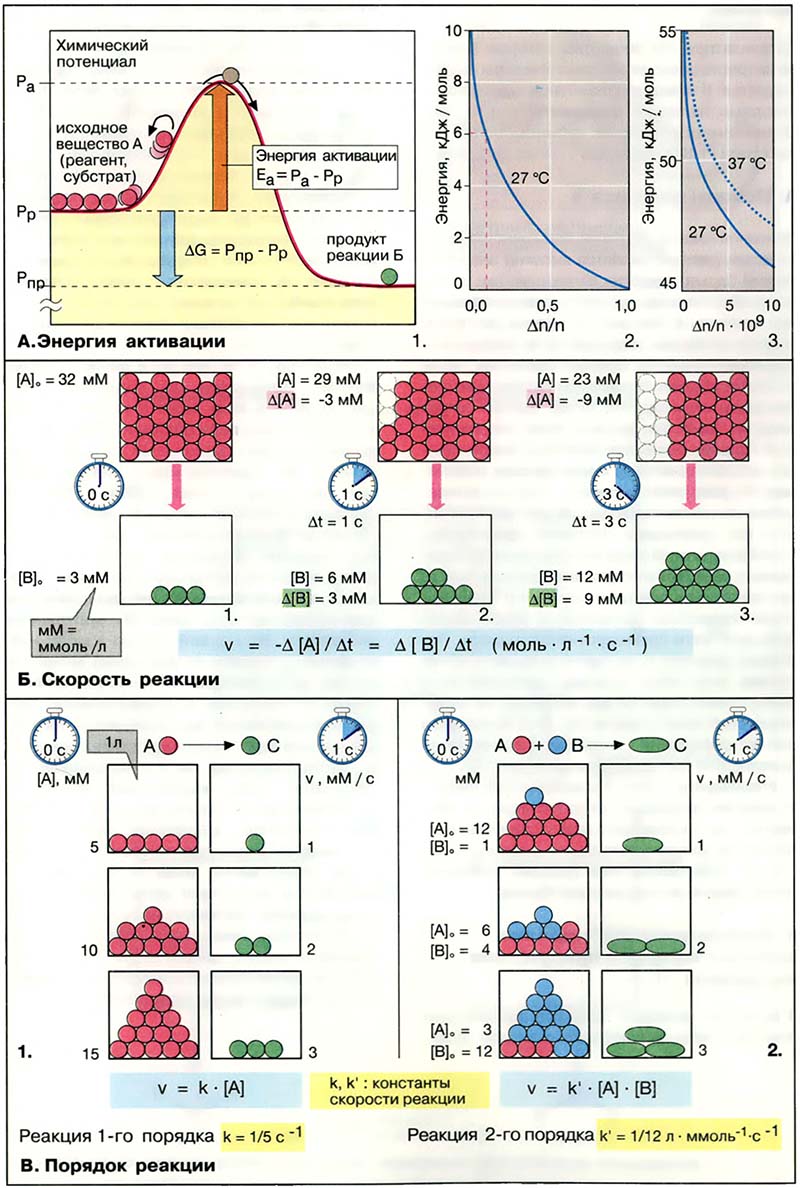
Скорость химической реакции определяют по изменению концентрации одного из реагентов или продуктов реакции за определённый период времени. В приведённом примере в 1 л раствора за 1 с расходуется 3 ммоля реагента и, в результате образуется 3 ммоля продукта. Это соответствует скорости реакции
v = 3 мМ×с-1 = 3×10-3 моль×л-1×с-1
v = 3 мМ×с-1 = 3×10-3 моль×л-1×с-1
Статьи раздела «Кинетика химических реакций»:
- Кинетика химических реакций
- А. Энергия активации
- Б. Скорость реакции
- В. Порядок реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Жизнь молекул в экстремальных условиях. Горячий микромир Камчатки
Жизнь молекул в экстремальных условиях. Горячий микромир Камчатки Книга посвящена исследованию вопроса о том, в каких предельных экстремальных ...
 Молекулярная и клеточная биология (комплект из 3 книг)
Молекулярная и клеточная биология (комплект из 3 книг) В книге известного учёного ФРГ на самом современном уровне обсуждены последние ...
Книга известного английского биохимика посвящена хемиосмотической теории, ...
 Физика белка. Курс лекций с цветными и стереоскопическими иллюстрациями и задачами
Физика белка. Курс лекций с цветными и стереоскопическими иллюстрациями и задачами Физика белка простирается от классификации и принципов устройства белков ...