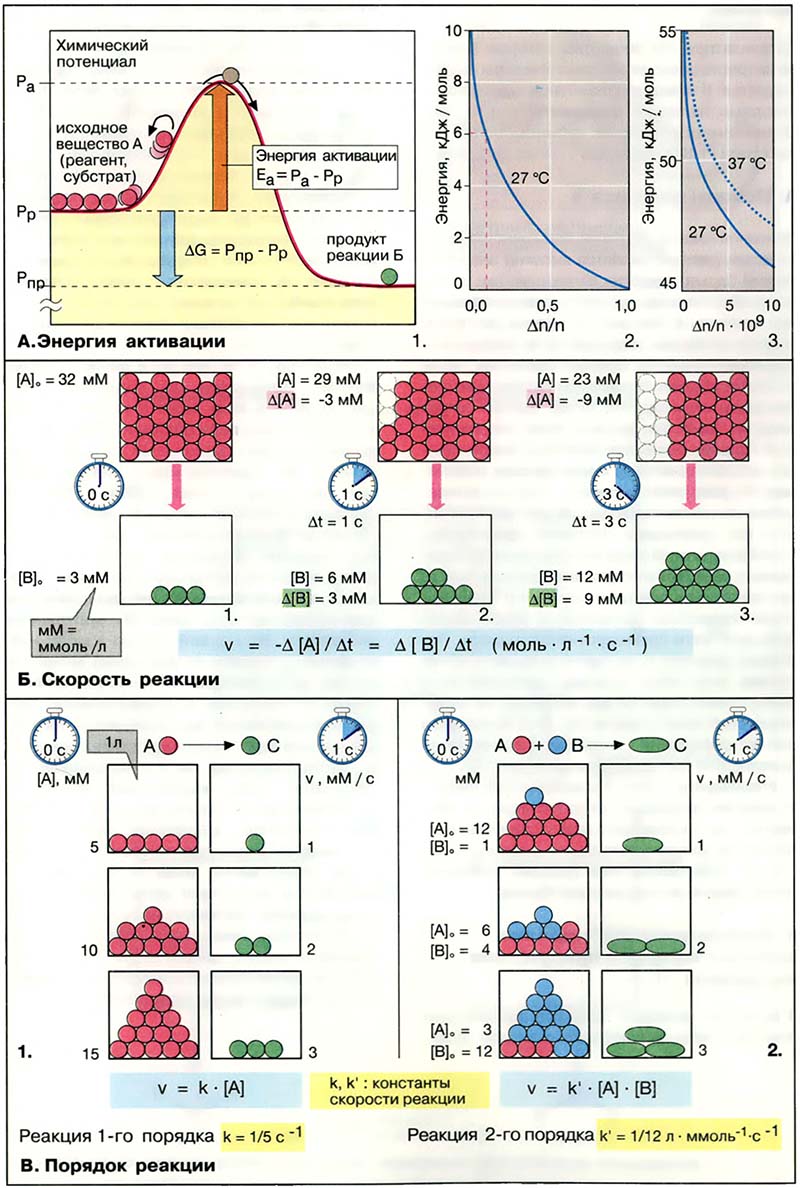
Большинство органических химических реакций (за исключением реакций кислот и оснований, см. Кислоты и основания) протекают очень медленно, независимо от величины ΔG. Главная причина низкой скорости реакции состоит в том, что для вступления в реакцию молекулы реагента должны обладать определённой минимальной энергией, называемой энергией активации. Наглядно это можно представить с помощью энергетической диаграммы наиболее простой реакции A → B (1). Каждое из соединений, реагент A и продукт реакции B, обладает определённым химическим потенциалом (Pр и Pпр соответственно). Изменение свободной энергии реакции (ΔG) соответствует разности потенциалов. Для превращения в B соединение A должно преодолеть энергетический барьер, пик которого Pа выше Pр. Разность потенциалов Pа — Pр носит название энергия активации (Еа).
В пользу того, что A, в принципе, может превратиться в B, свидетельствует то обстоятельство, что Рр является средним значением потенциала для всех молекул, вступающих в реакцию. Время от времени отдельные молекулы достигают гораздо более высокого потенциала, например за счёт столкновения с другими молекулами. Если в результате столкновения энергия молекулы превысит Еa, эта молекула перейдёт энергетический барьер и превратится в B. На рис. 2 и 3 приведено распределение энергии для молекулярных ансамблей, рассчитанное на простой модели. Δn/n это та часть молекул, которая обладает (или превышает) энергией Е (в кДж/моль). Например, при 27 °С около 10 % молекул обладают энергией около 6 кДж/моль. Энергия активации химических реакций обычно существенно выше. Аналогичный график для реакции с энергией активации около 50 кДж/моль приведён на рис. 3. Cтатистически при 27 °С такой энергией обладает только 2 из 109 молекул, при 37 °С — четыре молекулы (3). Подобная зависимость позволяет объяснить найденный эмпирическим путём температурный коэффициент скорости биологических процессов Q10, который означает, что при повышении температуры на 10 °С скорость реакции возрастает в 2 раза.
В пользу того, что A, в принципе, может превратиться в B, свидетельствует то обстоятельство, что Рр является средним значением потенциала для всех молекул, вступающих в реакцию. Время от времени отдельные молекулы достигают гораздо более высокого потенциала, например за счёт столкновения с другими молекулами. Если в результате столкновения энергия молекулы превысит Еa, эта молекула перейдёт энергетический барьер и превратится в B. На рис. 2 и 3 приведено распределение энергии для молекулярных ансамблей, рассчитанное на простой модели. Δn/n это та часть молекул, которая обладает (или превышает) энергией Е (в кДж/моль). Например, при 27 °С около 10 % молекул обладают энергией около 6 кДж/моль. Энергия активации химических реакций обычно существенно выше. Аналогичный график для реакции с энергией активации около 50 кДж/моль приведён на рис. 3. Cтатистически при 27 °С такой энергией обладает только 2 из 109 молекул, при 37 °С — четыре молекулы (3). Подобная зависимость позволяет объяснить найденный эмпирическим путём температурный коэффициент скорости биологических процессов Q10, который означает, что при повышении температуры на 10 °С скорость реакции возрастает в 2 раза.
Статьи раздела «Кинетика химических реакций»:
- Кинетика химических реакций
- А. Энергия активации
- Б. Скорость реакции
- В. Порядок реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Математические модели морфогенеза
Математические модели морфогенеза Автором предлагаемого курса лекций по математическим моделям морфогенеза ...
 How to Build a Dinosaur: The New Science of Reverse Evolution
How to Build a Dinosaur: The New Science of Reverse Evolution A world-renowned paleontologist reveals groundbreaking science that trumps science fiction: how to grow a living dinosaur Over a decade after Jurassic ...
Впервые в русскоязычной литературе системно изложены и даны толкования более 1 600 ...
 Fundamentals of Forensic DNA Typing
Fundamentals of Forensic DNA Typing An introductory text on forensic DNA analysis, written by the foremost expert in the field.