Большая группа протеиназ содержит в активном центре серин. К сериновым протеиназам принадлежат, например, ферменты пищеварения трипсин, химотрипсин и эластаза (см. Секреты пищеварительного тракта), многие факторы свертывания крови (см. Свёртывание крови), а также фибринолитический фермент плазмин и его активаторы (см. Фибринолиз. Группы крови).
Как показано в статье Процессы пищеварения, панкреатические протеиназы секретируются в виде проферментов (зимогенов). Активация таких ферментов основана на протеолитическом расщеплении. Процесс активации показан на примере трипсиногена, предшественника трипсина (1). Она начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»), специфической сериновой протеиназой, которая локализована в мембранах кишечного эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом (аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы A и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2. Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата расположена в С-концевой стороне от остатка лизина, боковая цепь которого во время катализа фиксируется в специальном «кармане» фермента (на схеме слева).
Как показано в статье Процессы пищеварения, панкреатические протеиназы секретируются в виде проферментов (зимогенов). Активация таких ферментов основана на протеолитическом расщеплении. Процесс активации показан на примере трипсиногена, предшественника трипсина (1). Она начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»), специфической сериновой протеиназой, которая локализована в мембранах кишечного эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом (аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы A и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2. Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата расположена в С-концевой стороне от остатка лизина, боковая цепь которого во время катализа фиксируется в специальном «кармане» фермента (на схеме слева).
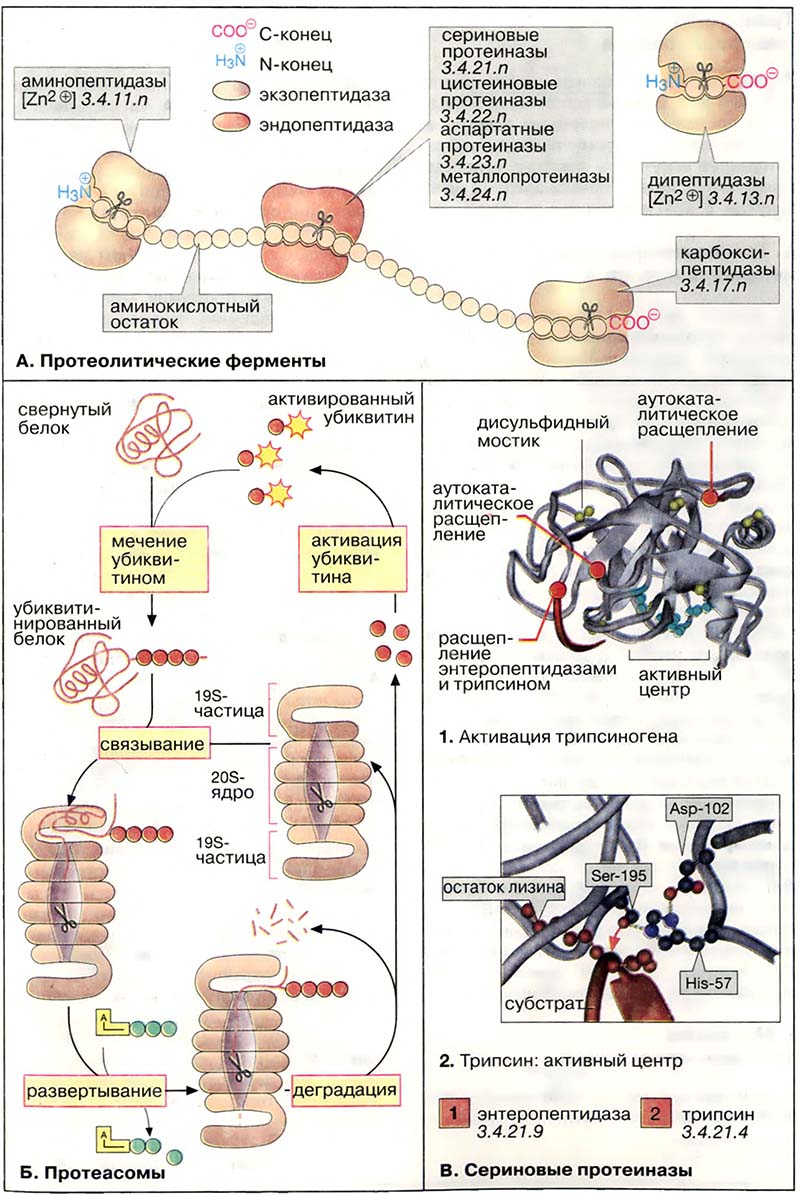
Статьи раздела «Протеолиз»:
- А. Протеолитические ферменты
- Б. Протеасомы
- В. Сериновые протеиназы
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors
Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors Protein glycation, induced by hyperglycemia, is implicated in the appearance of diabetic complications and the aging process. Glycation involves the ...
 Прикладная молекулярная биология. Изд.2
Прикладная молекулярная биология. Изд.2 В учебном пособии изложены основы молекулярной биологии, а также направления ...
 Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology
Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology Synthesizing over thirty years of advances into a comprehensive textbook, Biomolecular Crystallography describes the fundamentals, practices, and ...
