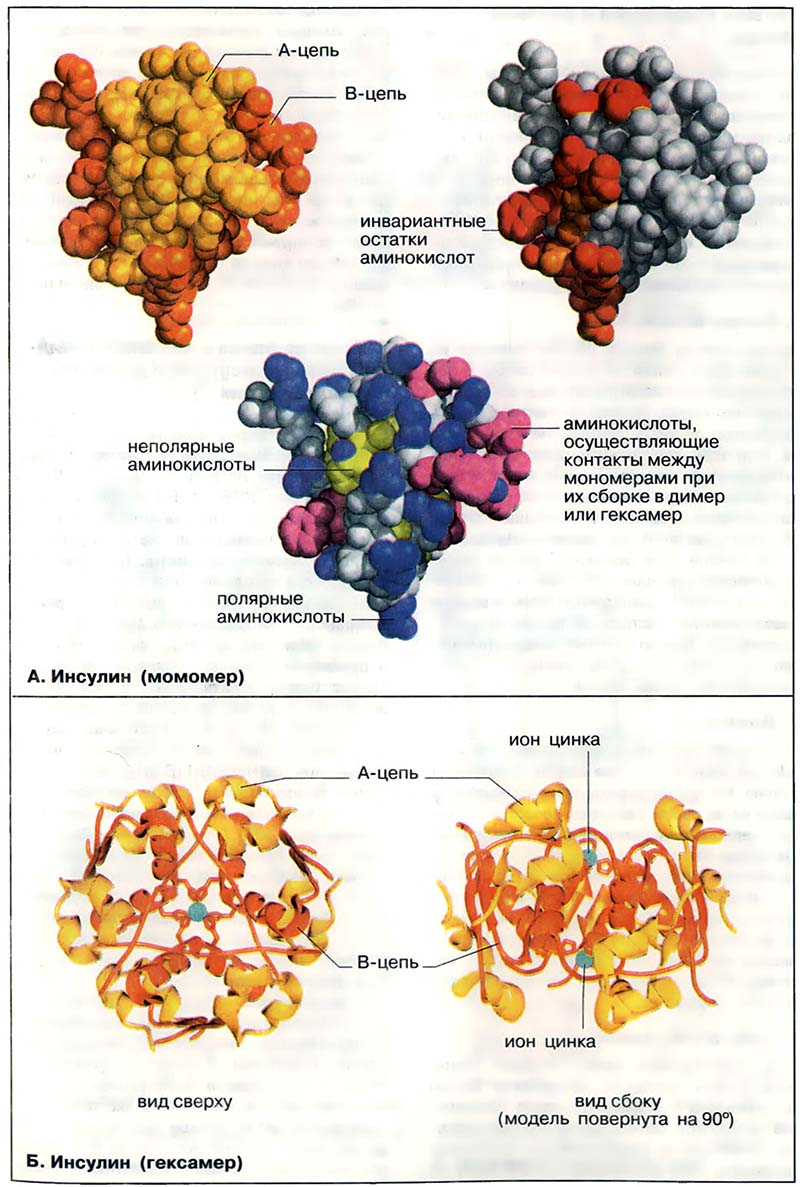
Мономер инсулина состоит из 51 аминокислотного остатка (см. Метаболизм жиров), т. е. по молекулярной массе (5,5 кДа) он вдвое уступает самому низкомолекулярному ферменту. Тем не менее инсулин остаётся типичным глобулярным белком. В растворе инсулин имеет четвертичную структуру, которая существенна для его сигнальной функции. На приведённой слева вандерваапьсовой модели A-цепь окрашена в жёлтый цвет, а B-цепь — в оранжевый. Известно, что молекула имеет клинообразную форму. Острие клина сформировано B-цепью, которая в этом месте меняет направление.
На модели (в центре) боковые группы полярных аминокислот (см. Цитратный цикл: метаболические функции) окрашены в синий цвет, а неполярные группы — в жёлтый или красно-фиолетовый. Это сделано с тем, чтобы подчеркнуть важное значение гидрофобного эффекта в свёртывании белков (см. Свёртывание белков). Большинство гидрофобных боковых цепей находится внутри глобулы, в то время как гидрофильные группировки остаются на поверхности. Этому правилу явно противоречит присутствие на поверхности неполярных боковых групп (окрашены в красно-фиолетовый цвет). Однако все эти группы принимают участие в гидрофобных взаимодействиях, стабилизирующих димер и гексамер инсулина (см. Б).
На модели справа выделены остатки, которые лежат на поверхности и инвариантны (красный цвет) или почти инвариантны (оранжевый цвет) для инсулина любого происхождения. При этом принималось во внимание, что наиболее важными в функциональном отношении являются аминокислотные остатки, не претерпевшие изменений в ходе эволюции. В инсулине почти все инвариантные остатки сгруппированы на одной стороне молекулы. Предположительно, эти аминокислоты принимают участие в связывании гормона с рецептором.
На модели (в центре) боковые группы полярных аминокислот (см. Цитратный цикл: метаболические функции) окрашены в синий цвет, а неполярные группы — в жёлтый или красно-фиолетовый. Это сделано с тем, чтобы подчеркнуть важное значение гидрофобного эффекта в свёртывании белков (см. Свёртывание белков). Большинство гидрофобных боковых цепей находится внутри глобулы, в то время как гидрофильные группировки остаются на поверхности. Этому правилу явно противоречит присутствие на поверхности неполярных боковых групп (окрашены в красно-фиолетовый цвет). Однако все эти группы принимают участие в гидрофобных взаимодействиях, стабилизирующих димер и гексамер инсулина (см. Б).
На модели справа выделены остатки, которые лежат на поверхности и инвариантны (красный цвет) или почти инвариантны (оранжевый цвет) для инсулина любого происхождения. При этом принималось во внимание, что наиболее важными в функциональном отношении являются аминокислотные остатки, не претерпевшие изменений в ходе эволюции. В инсулине почти все инвариантные остатки сгруппированы на одной стороне молекулы. Предположительно, эти аминокислоты принимают участие в связывании гормона с рецептором.
Статьи раздела «Молекулярные модели: инсулин»:
- Молекулярные модели: инсулин
- А. Инсулин (мономер)
- Б. Инсулин (гексамер)
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Биофизическая химия. В 3 томах. Том 3
Биофизическая химия. В 3 томах. Том 3 В книге изложены представления о биологических макромолекулах и методах ...
 Geobiology: Objectives, Concepts, Perspectives, First Edition
Geobiology: Objectives, Concepts, Perspectives, First Edition Book DescriptionGeobiology is an exciting and rapidly developing research discipline that opens new perspectives in understanding Earth as a system. ...
 Молекулярное моделирование. Теория и практика
Молекулярное моделирование. Теория и практика В научном издании, написанном учёными из Германии, Франции и Швейцарии, имеющими ...