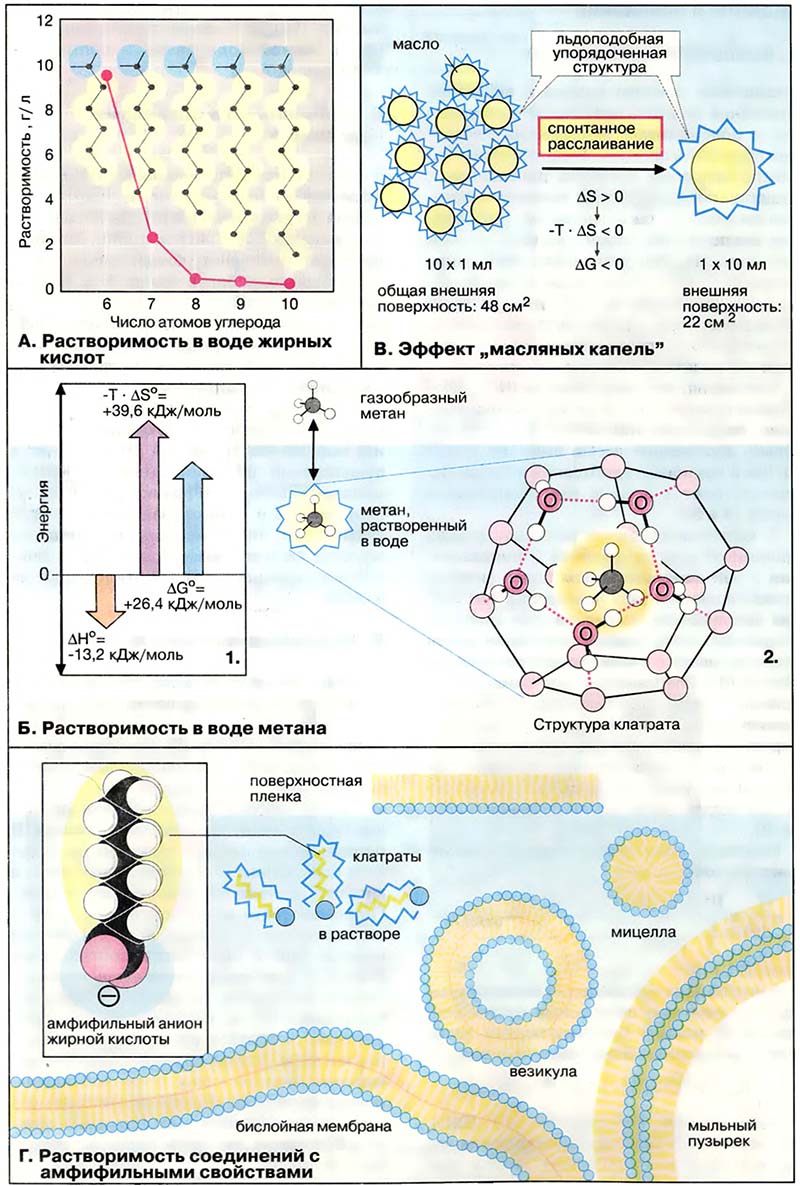
Для объяснения плохой растворимости углеводородов в воде необходимо прежде всего рассмотреть энергетику такого процесса (см. Энтальпия и энтропия). На схеме 1 приведены данные для наиболее простого углеводорода метана. Известно, что растворение газообразного метана в воде — процесс экзотермический (ΔH° меньше 0). Тем не менее изменение свободной энергии (ΔG°) — величина положительная, поскольку в уравнении преобладает энтропийный член (—Т×ΔS°). Очевидно, что изменение энтропии процесса (ΔS°) — величина отрицательная, то есть растворение метана в воде требует повышения степени упорядоченности системы. При окружении молекул метана молекулами воды подвижность молекул метана должна уменьшаться. Однако при этом существенно важнее то обстоятельство, что молекулы воды, располагаясь вокруг этих неполярных молекул, образуют собственную сетчатую структуру, «клатраты», стабилизированную, как и в структуре льда, водородными связями. Таким образом, растворение метана в воде — процесс, приводящий к более высокой упорядоченности водной фазы. Чем больше поверхность контакта между водой и неполярной фазой, тем выше степень такой упорядоченности.
Статьи раздела «Гидрофобные взаимодействия»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
В стенограмме публичной лекции характеризуется метод тканевых культур и ...
 Нанотехнология белков. Протоколы, оборудование, области применения
Нанотехнология белков. Протоколы, оборудование, области применения В этой книге, написанной ведущими экспертами, собраны последние достижения в ...
 Атлас. Морфология крахмала и крахмалопродуктов
Атлас. Морфология крахмала и крахмалопродуктов В атласе приведены данные о морфологической характеристике нативных крахмалов: ...
