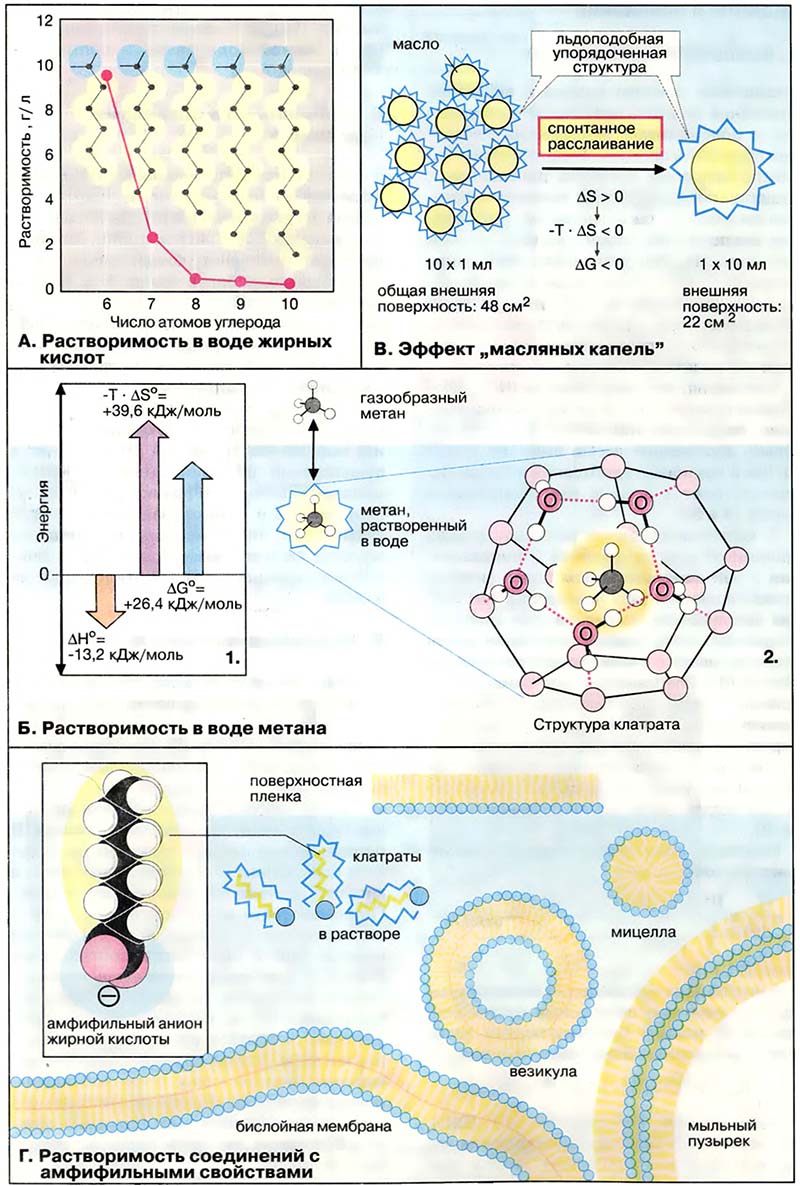
Для объяснения плохой растворимости углеводородов в воде необходимо прежде всего рассмотреть энергетику такого процесса (см. Энтальпия и энтропия). На схеме 1 приведены данные для наиболее простого углеводорода метана. Известно, что растворение газообразного метана в воде — процесс экзотермический (ΔH° меньше 0). Тем не менее изменение свободной энергии (ΔG°) — величина положительная, поскольку в уравнении преобладает энтропийный член (—Т×ΔS°). Очевидно, что изменение энтропии процесса (ΔS°) — величина отрицательная, то есть растворение метана в воде требует повышения степени упорядоченности системы. При окружении молекул метана молекулами воды подвижность молекул метана должна уменьшаться. Однако при этом существенно важнее то обстоятельство, что молекулы воды, располагаясь вокруг этих неполярных молекул, образуют собственную сетчатую структуру, «клатраты», стабилизированную, как и в структуре льда, водородными связями. Таким образом, растворение метана в воде — процесс, приводящий к более высокой упорядоченности водной фазы. Чем больше поверхность контакта между водой и неполярной фазой, тем выше степень такой упорядоченности.
Статьи раздела «Гидрофобные взаимодействия»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries)
Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries) During the upgrading of heavy petroleum, asphaltene is the most problematic impurity since it is the main cause of catalyst deactivation and sediments ...
 Cell Biology: With STUDENT CONSULT Online Access
Cell Biology: With STUDENT CONSULT Online Access A masterful, richly illustrated introduction to the cell biology that you need to know.
 Математические модели морфогенеза
Математические модели морфогенеза Автором предлагаемого курса лекций по математическим моделям морфогенеза ...
 История биологической химии. Институционализация биохимии
История биологической химии. Институционализация биохимии Книга посвящена вопросам истории формирования научных организаций в области ...