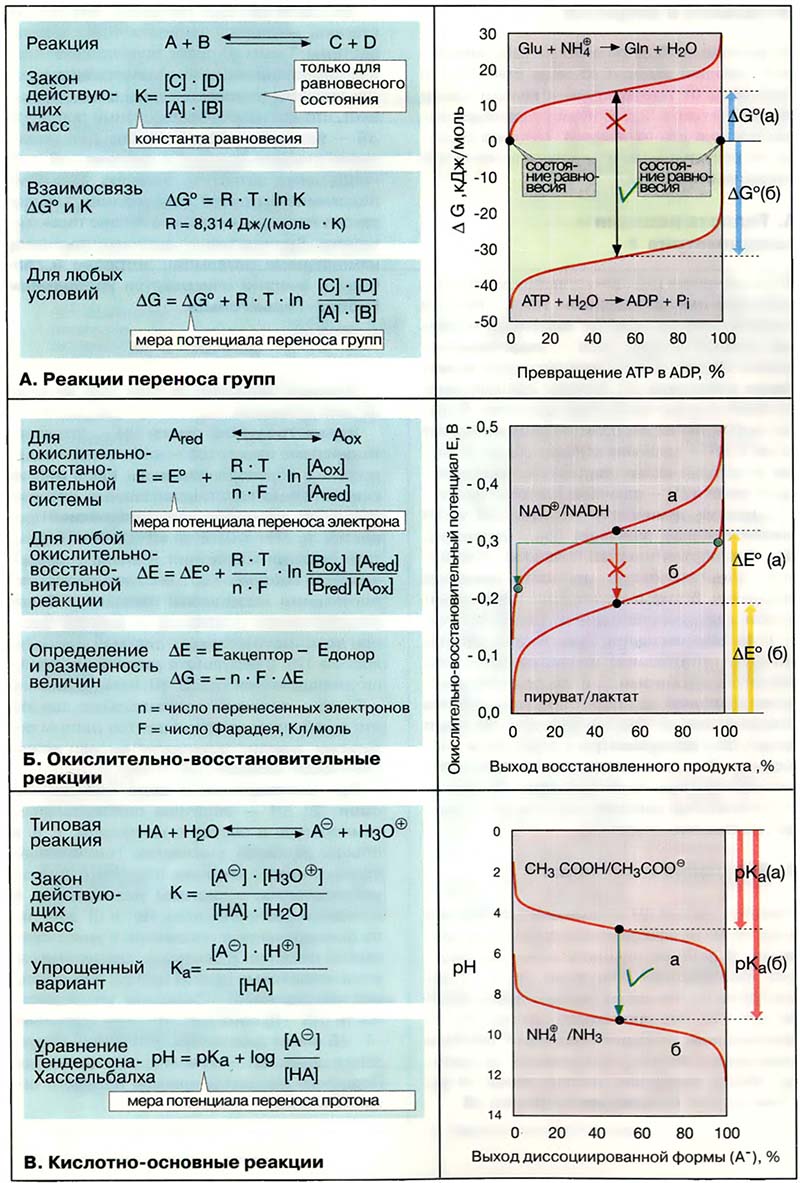
В реакциях переноса протона всегда принимает участие пара сопряжённых кислот и оснований (см. Кислоты и основания). Степень диссоциации кислотно-основной пары зависит от концентрации Н+. Чаще всего приводится не собственно концентрация протонов, а её отрицательный логарифм, величина pH. Взаимосвязь между pH и константой диссоциации описывается уравнением Гендерсона-Хассельбалха. В качестве меры химического потенциала переноса протона кислотно-основной пары служит величина рКа — отрицательный логарифм константы диссоциации кислоты Ka. Чем сильнее кислота, тем меньше её рКа. Кислоты с небольшими рКа могут протонировать основания с высокими рКа (зелёная стрелка).
Статьи раздела «Равновесие»:
- А. Реакции переноса групп
- Б. Окислительно-восстановительные реакции
- В. Кислотно-основные реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Review of Medical Microbiology and Immunology
Review of Medical Microbiology and Immunology To put your preparation for USMLE Step 1 and course exams on the fast track, only one resource will do: «Review of Medical Microbiology and ...
В книге обобщён большой опыт, накопленный за последние годы в области применения ...
 Фотосинтез: физико-химический подход
Фотосинтез: физико-химический подход Подробно обосновывается предложенная автором (1995) принципиально новая концепция ...