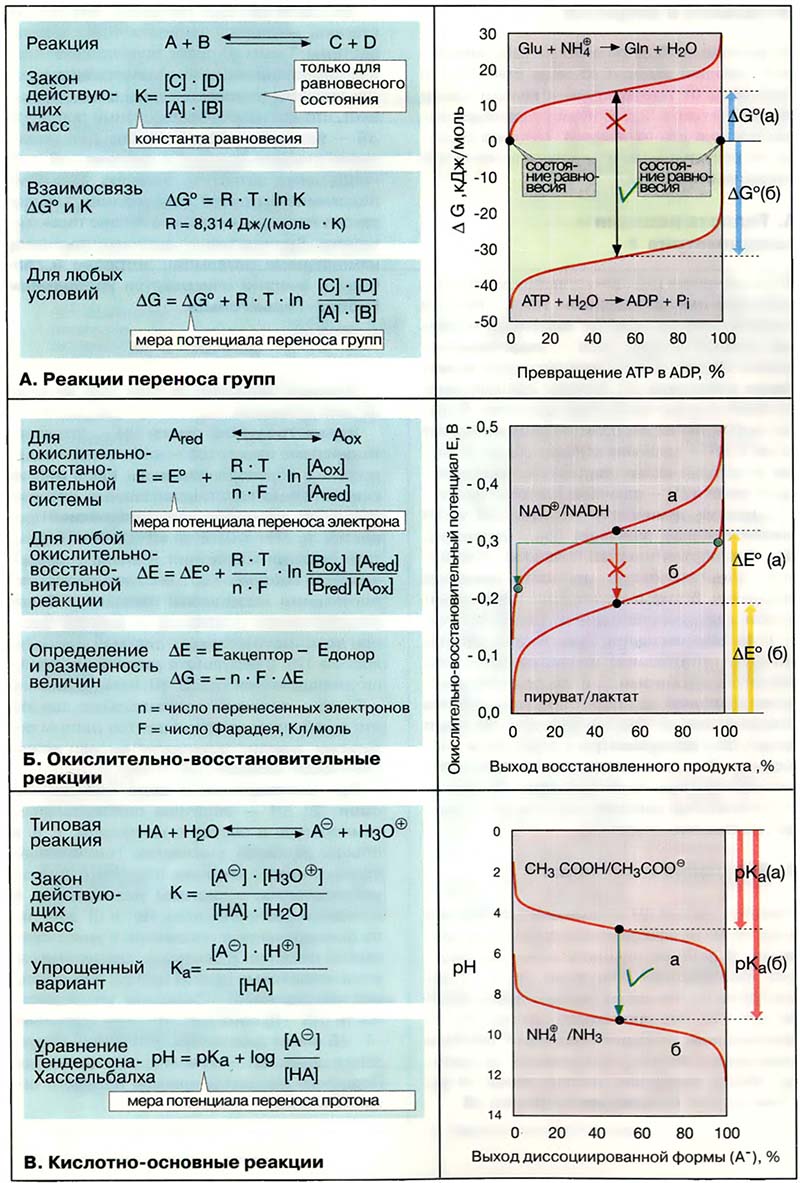
В реакциях переноса протона всегда принимает участие пара сопряжённых кислот и оснований (см. Кислоты и основания). Степень диссоциации кислотно-основной пары зависит от концентрации Н+. Чаще всего приводится не собственно концентрация протонов, а её отрицательный логарифм, величина pH. Взаимосвязь между pH и константой диссоциации описывается уравнением Гендерсона-Хассельбалха. В качестве меры химического потенциала переноса протона кислотно-основной пары служит величина рКа — отрицательный логарифм константы диссоциации кислоты Ka. Чем сильнее кислота, тем меньше её рКа. Кислоты с небольшими рКа могут протонировать основания с высокими рКа (зелёная стрелка).
Статьи раздела «Равновесие»:
- А. Реакции переноса групп
- Б. Окислительно-восстановительные реакции
- В. Кислотно-основные реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 История биологической химии. Институционализация биохимии
История биологической химии. Институционализация биохимии Книга посвящена вопросам истории формирования научных организаций в области ...
 Фотосинтез. В 2 томах (комплект)
Фотосинтез. В 2 томах (комплект) Книга, написанная в основном американскими авторами, представляет собой ...
 Математические модели морфогенеза
Математические модели морфогенеза Автором предлагаемого курса лекций по математическим моделям морфогенеза ...
 Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition)
Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition) The Third Edition of Microbiology with Diseases by Taxonomy is the most cutting-edge microbiology book available, offering unparalleled currency, ...