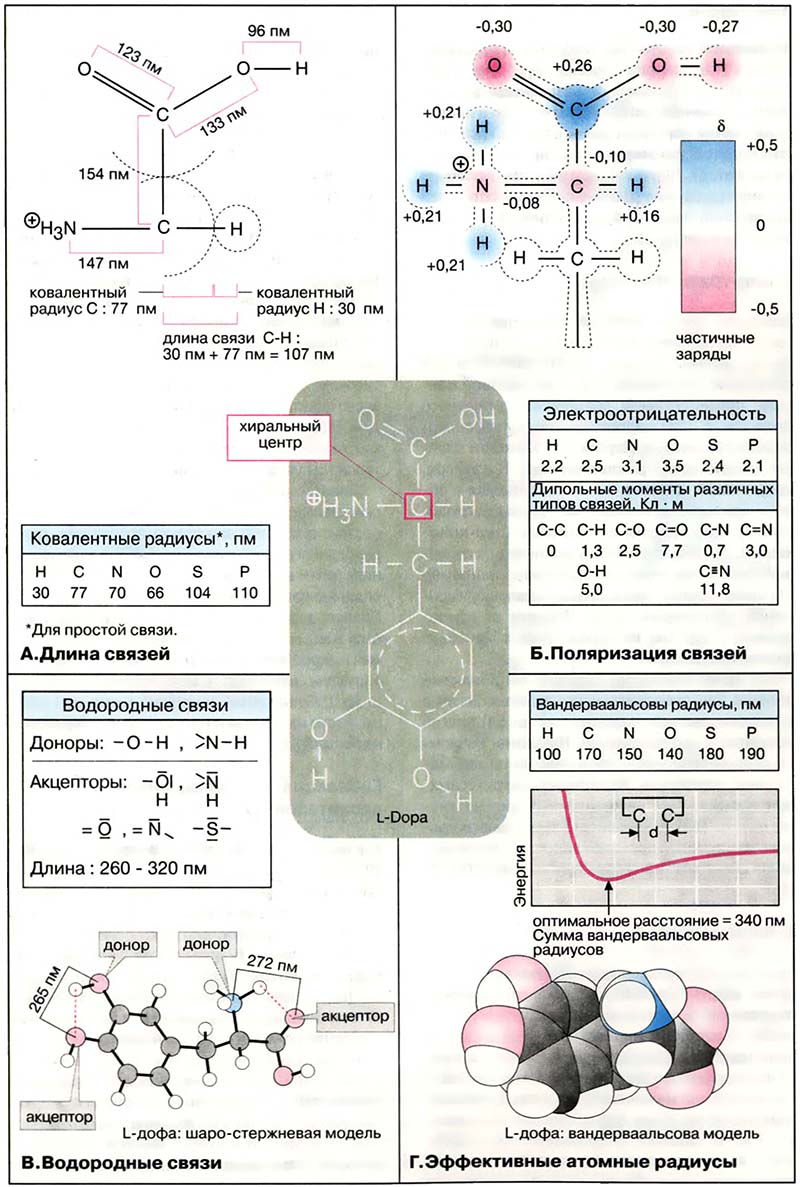
Для обозначения расстояний между атомами в молекуле используется понятие ковалентный радиус. Длина простой связи является величиной аддитивной: она примерно равна сумме ковалентных радиусов двух атомов. Двойная связь на 10-20 % короче простой связи. В последнее время атомные радиусы и расстояние между атомами принято выражать в пикометрах (пм, 1 пм = 10-12 м). Ранее длину связей представляли в ангстремах (Å , 1 Å = 100 пм).
Статьи раздела «Строение молекул»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Fundamentals of Forensic DNA Typing
Fundamentals of Forensic DNA Typing An introductory text on forensic DNA analysis, written by the foremost expert in the field.
В книге обобщён большой опыт, накопленный за последние годы в области применения ...
Учебное пособие освещает систематизированную совокупность современных знаний ...