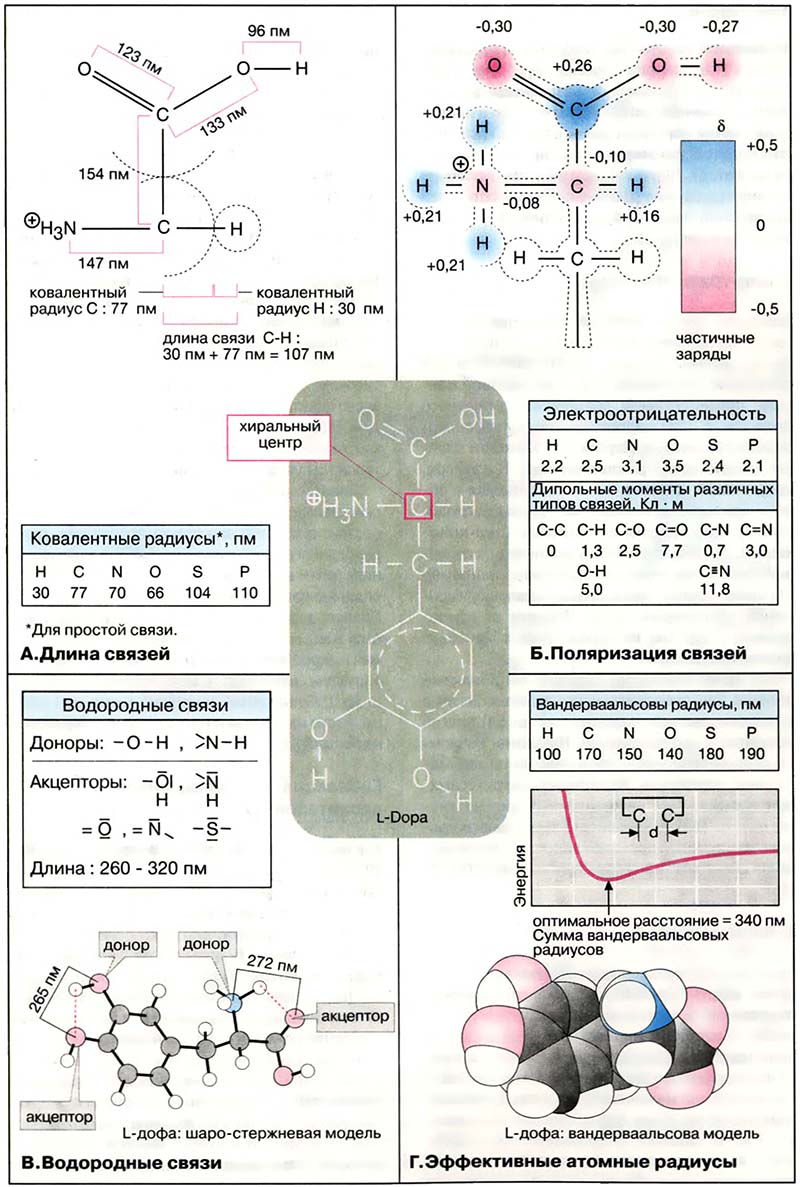
Особый тип нековалентной связи — водородная связь — имеет в биохимии исключительно важное значение. В образовании водородной связи принимают участие атомы водорода OH-, NH- и SH-групп (так называемых доноров водородной связи), которые взаимодействуют со свободной парой электронов атомов-акцепторов (например, O, N или S). Энергия водородной связи составляет 10-40 кДж/моль, что значительно меньше энергии ковалентной связи (меньше 400 кДж/моль). Однако многочисленные водородные связи вносят существенный вклад в стабилизацию структуры многих макромолекул (см. Глюконеогенез, Дезоксирибонуклеиновые кислоты). Например, L-дофа может образовывать две внутримолекулярные водородные связи. На шаро-стержневой модели L-дофа водородные мостики указаны штрихами.
Статьи раздела «Строение молекул»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Биофизическая химия. В 3 томах. Том 3
Биофизическая химия. В 3 томах. Том 3 В книге изложены представления о биологических макромолекулах и методах ...
 Паразитические нематоды растений и насекомых
Паразитические нематоды растений и насекомых В книге представлены обобщающие работы по современным теоретическим и ...
Монография посвящена одному из самых информативных методов физико-химической ...