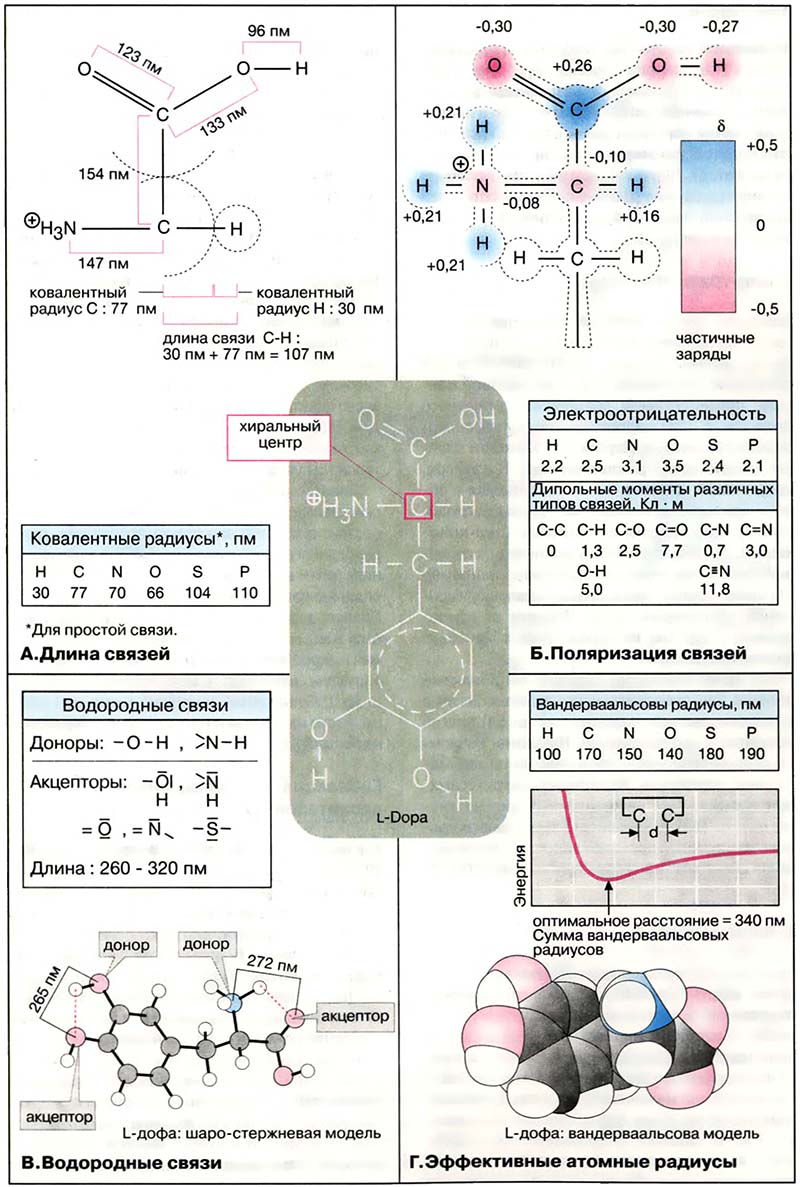
Особый тип нековалентной связи — водородная связь — имеет в биохимии исключительно важное значение. В образовании водородной связи принимают участие атомы водорода OH-, NH- и SH-групп (так называемых доноров водородной связи), которые взаимодействуют со свободной парой электронов атомов-акцепторов (например, O, N или S). Энергия водородной связи составляет 10-40 кДж/моль, что значительно меньше энергии ковалентной связи (меньше 400 кДж/моль). Однако многочисленные водородные связи вносят существенный вклад в стабилизацию структуры многих макромолекул (см. Глюконеогенез, Дезоксирибонуклеиновые кислоты). Например, L-дофа может образовывать две внутримолекулярные водородные связи. На шаро-стержневой модели L-дофа водородные мостики указаны штрихами.
Статьи раздела «Строение молекул»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Авторы монографии поставили перед собой задачу отобрать наиболее достоверные и ...
В стенограмме публичной лекции характеризуется метод тканевых культур и ...
