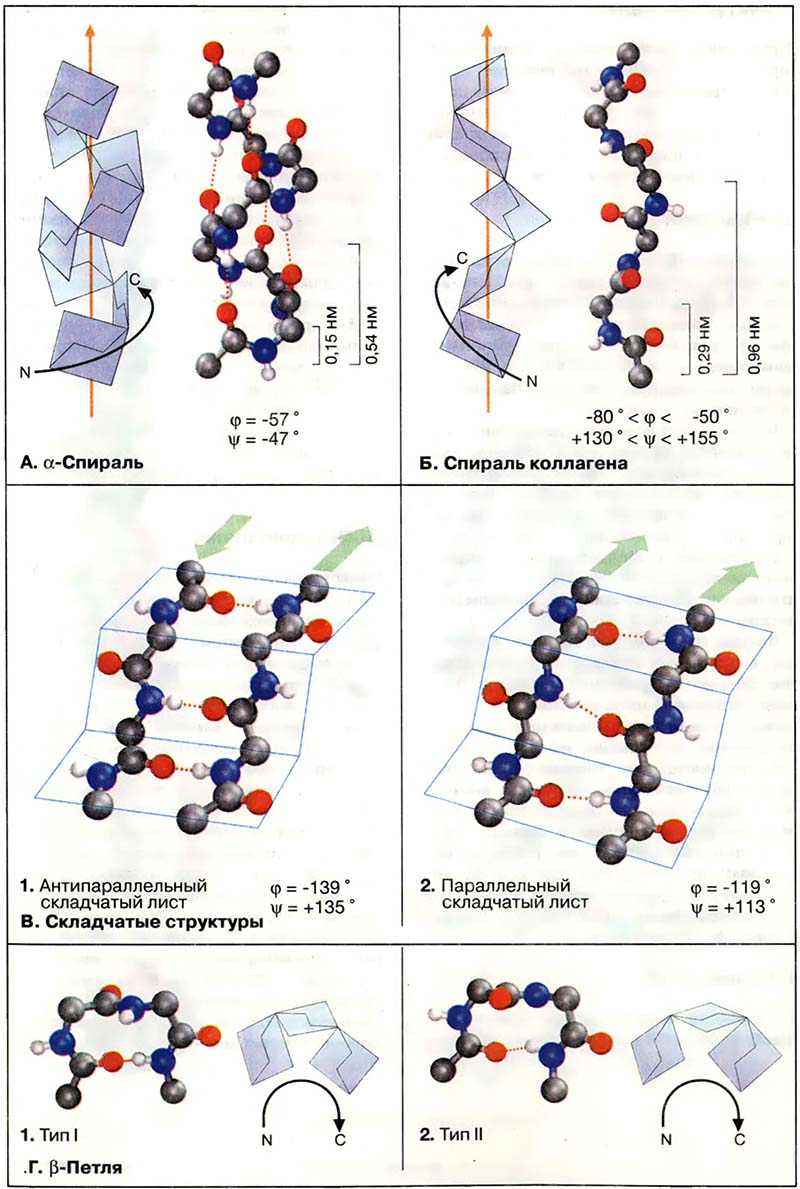
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка расположены таким образом, что цепь делает реверсивный поворот (на 180°). Оба приведённых на схеме варианта петли (типы I и II) встречаются довольно часто. Обе структуры стабилизированы водородным мостиком между 1 и 4 остатками.
Статьи раздела «Вторичные структуры белков»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Защита от биоповреждений, вызываемых грибами
Защита от биоповреждений, вызываемых грибами Книга посвящена проблеме снижения химической и биологической опасности в сфере ...
В монографии рассматривается история развития учения об «антропотоксинах», ...
 Внутриклеточная Са2+-зависимая протеолитическая система животных
Внутриклеточная Са2+-зависимая протеолитическая система животных Монография представляет собой обобщающее издание, основанное на анализе ...
 Principles of Biomedical Informatics
Principles of Biomedical Informatics Biomedical informatics (BMI) is an extraordinarily broad discipline. In scale, it spans across genes, cells, tissues, organ systems, individual ...