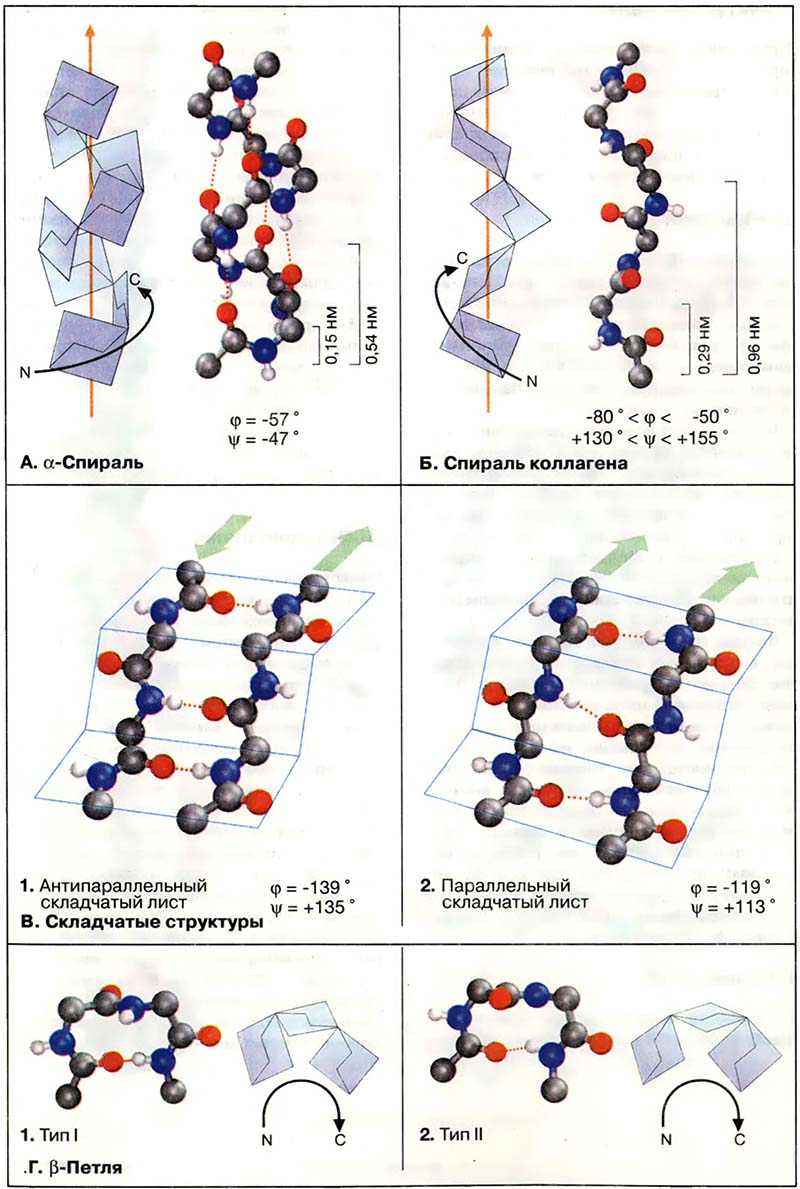
Наиболее распространённым элементом вторичной структуры является правая а-спираль (αR). Пептидная цепь здесь изгибается винтообразно (ось выделена оранжевым цветом). На каждый виток приходится 3,6 аминокислотного остатка, шаг винта (то есть минимальное расстояние между двумя эквивалентными точками) составляет 0,54 нм. α-Спираль стабилизирована почти линейными водородными связями (красный пунктир, см. Кислоты и основания) между NH-группой и CO-группой четвёртого по счету аминокислотного остатка. Таким образом, в протяжённых спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей. Неполярные или амфифильные α-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах (трансмембранные спирали, см. Транспорт газов, Биомембраны: структура и функции).
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Статьи раздела «Вторичные структуры белков»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Фотосинтез: физико-химический подход
Фотосинтез: физико-химический подход Подробно обосновывается предложенная автором (1995) принципиально новая концепция ...
 Yeast: Molecular and Cell Biology
Yeast: Molecular and Cell Biology Yeast is one of the oldest domesticated organisms and has both industrial and domestic applications. In addition, it is very widely used as a ...
 Введение в молекулярную биологию
Введение в молекулярную биологию Книга представляет собой переработанный курс лекций, который авторы читают ...