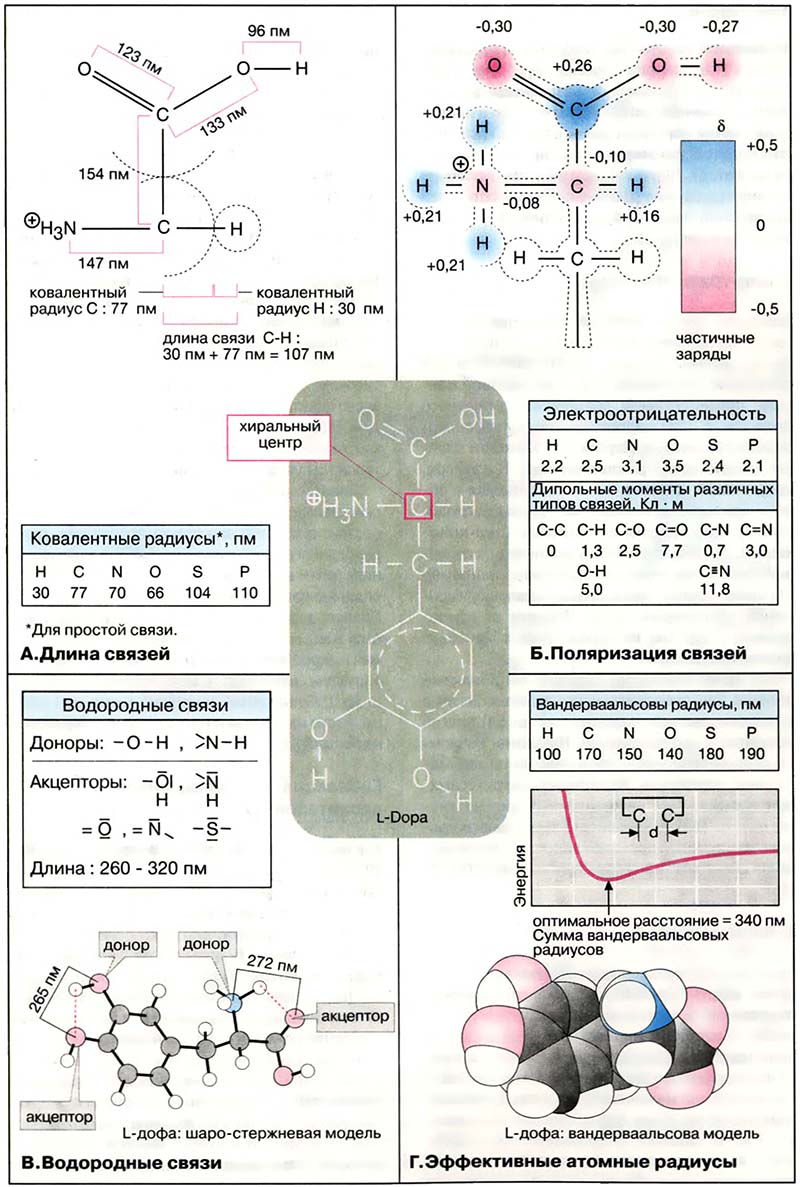
Для обозначения расстояний между атомами в молекуле используется понятие ковалентный радиус. Длина простой связи является величиной аддитивной: она примерно равна сумме ковалентных радиусов двух атомов. Двойная связь на 10-20 % короче простой связи. В последнее время атомные радиусы и расстояние между атомами принято выражать в пикометрах (пм, 1 пм = 10-12 м). Ранее длину связей представляли в ангстремах (Å , 1 Å = 100 пм).
Статьи раздела «Строение молекул»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Биофизическая химия (комплект из 2 книг)
Биофизическая химия (комплект из 2 книг) В трёхтомном издании, написанном учёными из США, на самом современном уровне ...
 Открытие основных законов жизни
Открытие основных законов жизни В книге изложены история развития и основные достижения молекулярной биологии — ...
 Новейшие методы исследования биосистем
Новейшие методы исследования биосистем Книга охватывает широкий круг методов, таких как молекулярная динамика, ...
 Интеллектуальные липидные наноконтейнеры в адресной доставке лекарственных веществ
Интеллектуальные липидные наноконтейнеры в адресной доставке лекарственных веществ Настоящая книга рассказывает о новейших достижениях в использовании липидов и ...