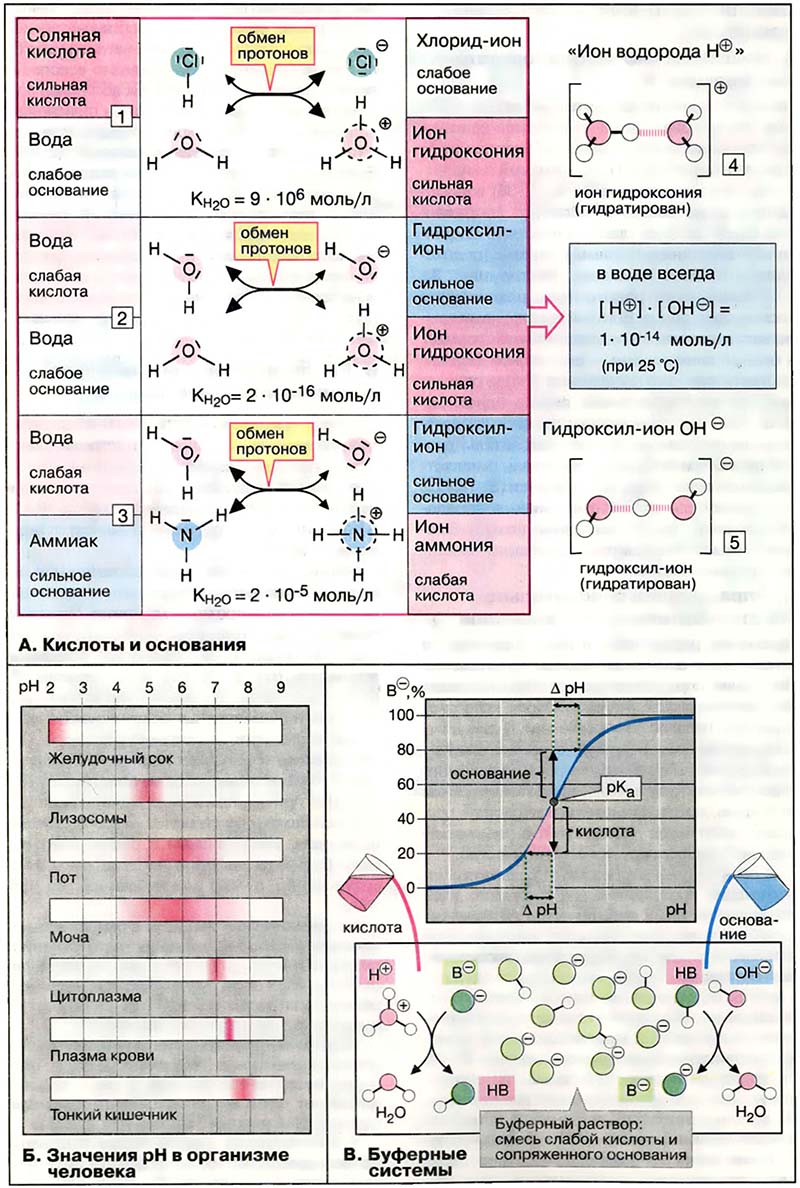
Кислотами принято называть вещества, способные отдавать протоны (ионы водорода), а основаниями — вещества, способные принимать протоны. Вода усиливает кислотно-основные свойства растворенных веществ, поскольку может выполнять функции как кислоты, так и основания. Так, соляная кислота (HCl) отдаёт протоны молекулам воды (1). При этом образуются анион хлора (Cl-) и протонированные молекулы воды (ионы гидроксония, H3O+, для краткости обозначаемые H+). Обмен протонами между HCl и водой идёт почти количественно, то есть в воде HCl ведёт себя как сильная кислота.
Основания, например аммиак (NH3), принимают протоны у молекул воды с образованием гидроксил-ионов (OH-) и положительно заряженных ионов аммония (NH4+, 3). Как и все ионы, гидроксоний и гидроксил присутствуют в воде в гидратированной форме (4 и 5).
В кислотно-основных реакциях всегда принимают участие кислота и сопряжённое с ней основание. Чем более сильной является кислота (или основание), тем слабее сопряжённое основание (или кислота). Например, очень слабое основание анион хлора сопряжён с очень сильной соляной кислотой (1). Слабокислый ион аммония сопряжён с умеренно сильным основанием аммиаком (3). Если молекула воды функционирует как слабая кислота, образуется гидроксил-ион — очень сильное основание. Если вода выступает как основание, образуется ион гидроксония — очень сильная кислота (2).
Константа диссоциации воды (2) — величина ничтожно низкая:
KH2O = [H+][H+][OH-] / [H2O] = 2×1016 моль/л
(при 25 °С)
В чистой воде концентрация молекул воды [H2O] — величина практически постоянная, равная 55 моль/л. При подстановке этого значения в уравнение оно принимает вид
Kw = [Н+][OH-] = 1×10-14 моль/л
Таким образом, произведение [Н+]×[OH-], так называемое ионное произведение воды, есть величина постоянная, даже в присутствии в растворе других кислотно-основных пар. При 25 °С концентрации ионов Н+ и OH- в чистой воде равны и составляют 1×10-7 моль/л.
Основания, например аммиак (NH3), принимают протоны у молекул воды с образованием гидроксил-ионов (OH-) и положительно заряженных ионов аммония (NH4+, 3). Как и все ионы, гидроксоний и гидроксил присутствуют в воде в гидратированной форме (4 и 5).
В кислотно-основных реакциях всегда принимают участие кислота и сопряжённое с ней основание. Чем более сильной является кислота (или основание), тем слабее сопряжённое основание (или кислота). Например, очень слабое основание анион хлора сопряжён с очень сильной соляной кислотой (1). Слабокислый ион аммония сопряжён с умеренно сильным основанием аммиаком (3). Если молекула воды функционирует как слабая кислота, образуется гидроксил-ион — очень сильное основание. Если вода выступает как основание, образуется ион гидроксония — очень сильная кислота (2).
Константа диссоциации воды (2) — величина ничтожно низкая:
KH2O = [H+][H+][OH-] / [H2O] = 2×1016 моль/л
(при 25 °С)
В чистой воде концентрация молекул воды [H2O] — величина практически постоянная, равная 55 моль/л. При подстановке этого значения в уравнение оно принимает вид
Kw = [Н+][OH-] = 1×10-14 моль/л
Таким образом, произведение [Н+]×[OH-], так называемое ионное произведение воды, есть величина постоянная, даже в присутствии в растворе других кислотно-основных пар. При 25 °С концентрации ионов Н+ и OH- в чистой воде равны и составляют 1×10-7 моль/л.
Статьи раздела «Кислоты и основания»:
- А. Кислоты и основания
- Б. Значения pH в организме человека
- В. Буферные системы
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors
Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors Protein glycation, induced by hyperglycemia, is implicated in the appearance of diabetic complications and the aging process. Glycation involves the ...
 Открытие основных законов жизни
Открытие основных законов жизни В книге изложены история развития и основные достижения молекулярной биологии — ...
 Введение в биофизическую химию
Введение в биофизическую химию Книга представляет собой руководство по биофизической химии, в котором кратко и ...
 Practical Forensic Microscopy: A Laboratory Manual
Practical Forensic Microscopy: A Laboratory Manual Forensic Microscopy: A Laboratory Manual will provide the student with a practical overview and understanding of the various microscopes and ...