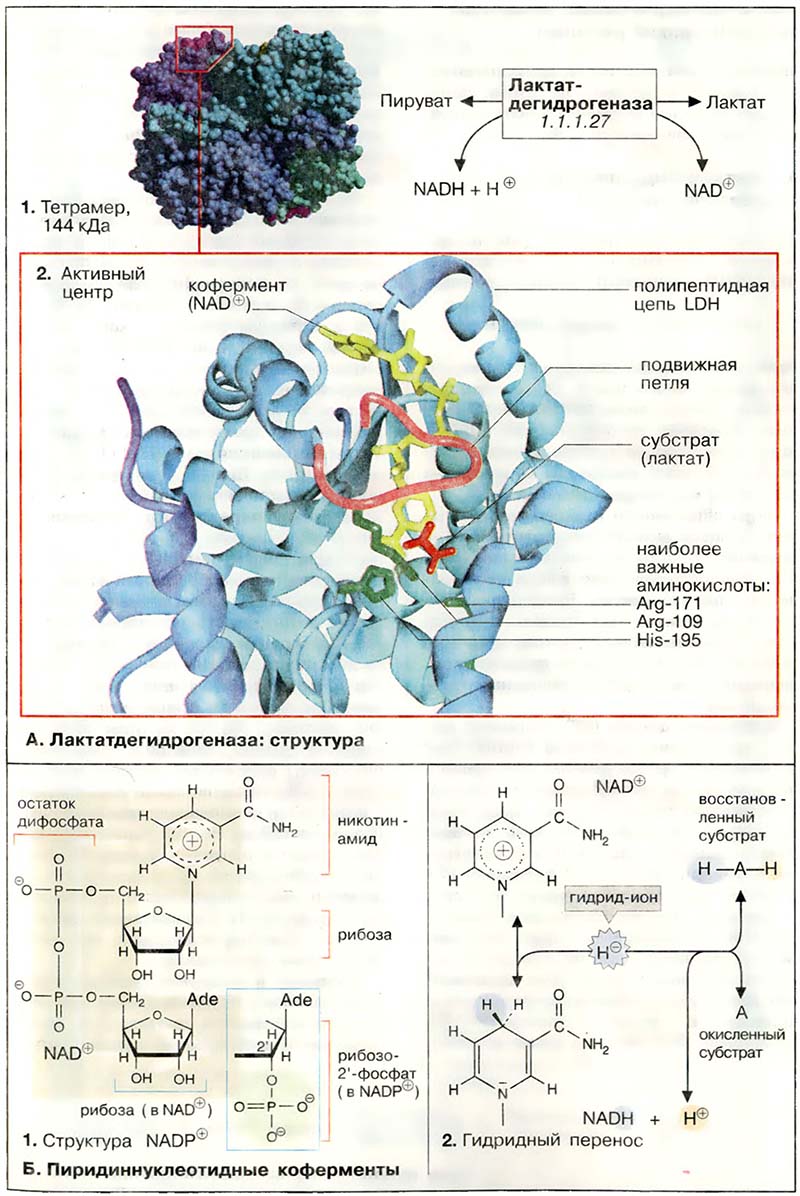
Активной формой лактатдегидрогеназы (молекулярная масса 144 кДа) является тетраметр из 4 субъединиц (1). Каждая субъединица образована пептидной цепью из 334 аминокислот (36 кДа). В тетрамере субъединицы занимают эквивалентные положения (1); каждый мономер содержит активный центр.
В организме млекопитающих имеются два различных типа субъединиц ЛДГ (Н и М), незначительно различающиеся по аминокислотной последовательности; они могут ассоциировать в тетрамер случайным образом. Поэтому известно 5 различных изоферментов ЛДГ. В мышце сердца содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (Н от англ. heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Активный центр в субъединице ЛДГ схематически показан на рис. 2. При этом пептидный остов белка изображён в виде ленты (светло-голубой), дополнительно представлены молекулы: субстрата — лактата (красного цвета), кофермента НАД+ (жёлтого цвета) и три боковые цепи аминокислот (зелёного цвета), которые участвуют непосредственно в катализе. Кроме того, выделена пептидная петля (малинового цвета), образованная аминокислотными остатками 98-111. В отсутствие субстрата и кофермента эта структура раскрыта, что обеспечивает свободный доступ к субстратсвязывающему участку (не показано). На рисунке представлен блокированный активный центр в комплексе фермент-лактат-НАД+. Детали каталитического цикла лактатдегидрогеназы обсуждаются в следующем разделе.
В организме млекопитающих имеются два различных типа субъединиц ЛДГ (Н и М), незначительно различающиеся по аминокислотной последовательности; они могут ассоциировать в тетрамер случайным образом. Поэтому известно 5 различных изоферментов ЛДГ. В мышце сердца содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (Н от англ. heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Активный центр в субъединице ЛДГ схематически показан на рис. 2. При этом пептидный остов белка изображён в виде ленты (светло-голубой), дополнительно представлены молекулы: субстрата — лактата (красного цвета), кофермента НАД+ (жёлтого цвета) и три боковые цепи аминокислот (зелёного цвета), которые участвуют непосредственно в катализе. Кроме того, выделена пептидная петля (малинового цвета), образованная аминокислотными остатками 98-111. В отсутствие субстрата и кофермента эта структура раскрыта, что обеспечивает свободный доступ к субстратсвязывающему участку (не показано). На рисунке представлен блокированный активный центр в комплексе фермент-лактат-НАД+. Детали каталитического цикла лактатдегидрогеназы обсуждаются в следующем разделе.
Статьи раздела «Лактатдегидрогеназа: структура»:
- Лактатдегидрогеназа: структура
- А. Лактатдегидрогеназа: структура
- Б. Пиридиннуклеотидные коферменты
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Металлы, находящиеся в незначительных количествах внутри живого организма, ...
 Планета вирусов
Планета вирусов Вирусы — невидимые, но активные участники борьбы за место в биосфере Земли. С их ...
В книге обобщён большой опыт, накопленный за последние годы в области применения ...
 История биологической химии. Формирование биохимии
История биологической химии. Формирование биохимии Книга посвящена истории формирования классической биохимии в период с середины ...