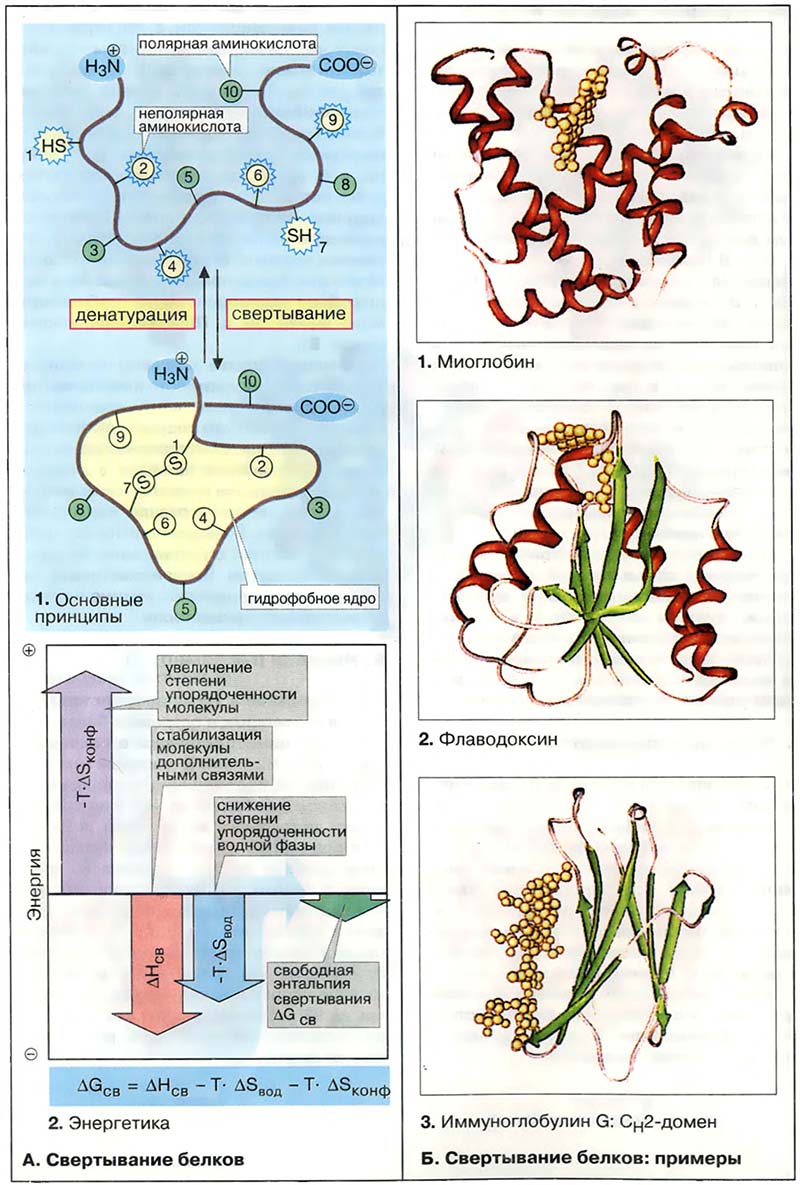
Информация относительно биологически активной (нативной) конформации полипептидной цепи закодирована в аминокислотной последовательности. Вторичные, третичные и четвертичные структуры многих белков образуются в растворе самопроизвольно в пределах нескольких минут. Тем не менее в клетке имеются специальные белки (шапероны, см. Транслокация белков. Шапероны), функция которых обеспечивать свёртывание полипептидных цепей вновь синтезируемых белков. Выяснение закономерностей свёртывания полипептидных цепей является одной из важнейших задач биохимии. В случае успеха появилась бы возможность предсказывать нативные конформации белков на основании данных об аминокислотных последовательностях, реконструируемых на основании относительно легко доступных ДНК-последовательностей (см. Секвенирование ДНК).
Статьи раздела «Свёртывание белков»:
- Свёртывание белков
- А. Свёртывание белков
- Б. Свёртывание белков: примеры
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Микрокосм. E. coli и новая наука о жизни
Микрокосм. E. coli и новая наука о жизни Цитата «В начале XX в. учёные, стремясь познать природу жизни, начали исследовать ...
 Современные успехи химии и биологии моря
Современные успехи химии и биологии моря Книга Харвея, содержащая много фактического материала и интересных выводов, ...
 Introductory Microbiology
Introductory Microbiology As a component of biology, Plant Pathology enjoyed a prestigious position and its applied aspects; plant disease management was an integral part of ...
 Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition)
Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition) The Third Edition of Microbiology with Diseases by Taxonomy is the most cutting-edge microbiology book available, offering unparalleled currency, ...