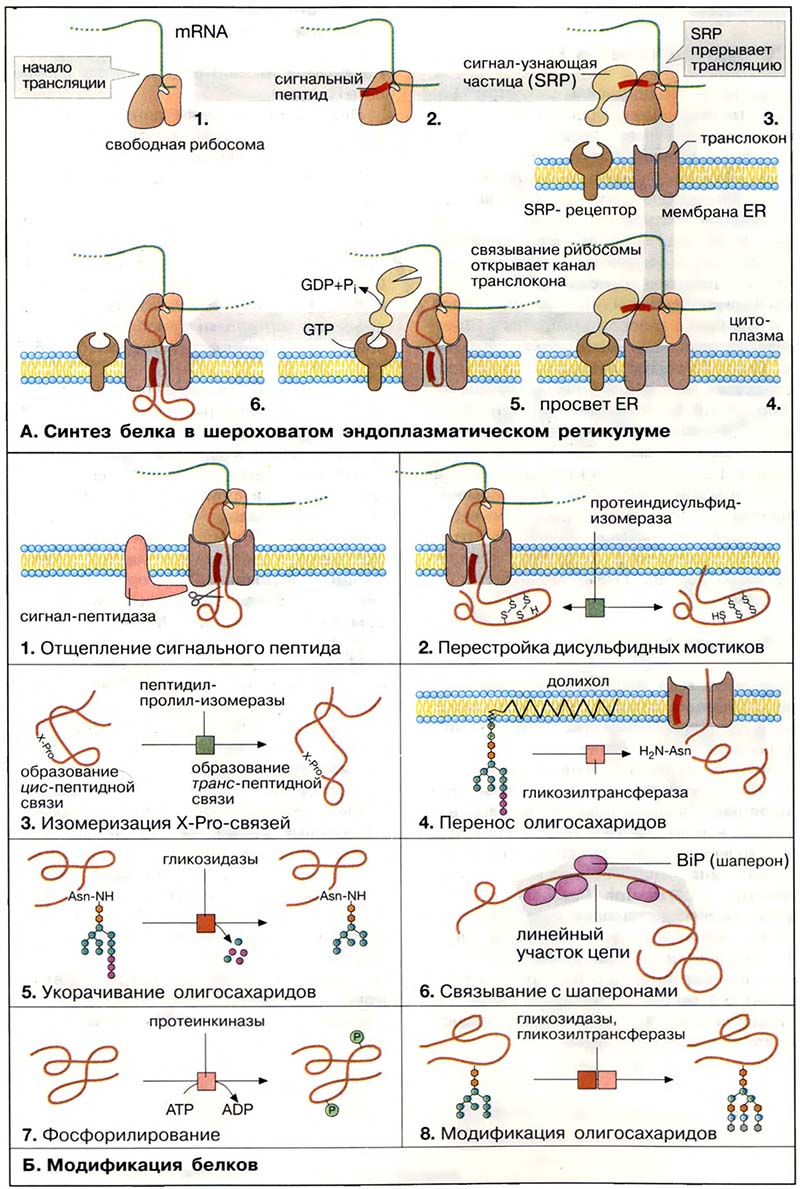
Модификации в ШЭР. Превращение линейной немодифицированной пептидной цепи в полноценный функциональный белок (созревание) осуществляется в результате многостадийного процесса, который начинается сразу же после начала трансляции и протекает в просвете ЭР.
Прежде всего соответствующая пептидаза отщепляет сигнальный пептид (1). Фермент узнает точку расщепления в составе специфической N-концевой последовательности белка.
Путём окисления боковых цепей цистеина образуются дисульфидные мостики, правильность положения которых контролируется протеиндисульфидизомеразой (2).
Пептидилпролил-изомераза контролирует цис-транс-изомеризацию X-Pro-связей в синтезируемом пептиде (3).
Трансгликозидазы переносят олигосахариды в блоке с долихолом (длинноцепочечным изопреноидом) на определённые остатки аспарагиновой кислоты в белке, тем самым осуществляя N-гликозилирование белка (4).
Гликозидазы «подстригают» олигосахариды, отщепляя избыточные остатки глюкозы и маннозы (5).
Для того чтобы растущая полипептидная цепь могла свернуться необходимым образом, с ещё линейным участком цепи временно связываются шапероны (6). Эти белки направляют процесс свёртывания цепи путём подавления нежелательных побочных взаимодействий. Наиболее важным шапероном, присутствующим в просвете ШЭР, является белок связывания (BiP, от англ. binding protein). Когда вновь образованный белок приобретает правильную вторичную и третичную структуру и остатки глюкозы удалены полностью, он с помощью транспортных везикул перемещается в аппарат Гольджи (см. Транслокация белков. Шапероны).
Модификации в аппарате Гольджи. В аппарате Гольджи осуществляются следующие ферментативные стадии модификации белка: фосфорилирование (7) и отщепление с последующим переносом (перегруппировка) остатков сахаров с помощью гликозидаз и гликозилтрансфераз (8). Эта модификация имеет целью образование специфической олигосахаридной структуры в гликопротеинах.
Наконец, в секреторных пузырьках (везикулах) отщепляется ещё один пептид (9), прежде чем содержимое секретируется посредством экзоцитоза. Это отщепление, катализируемое специфичными пептидазами, выполняет функцию активации секретируемого белка. Например, отщепление C-пептида от неактивного проинсулина приводит к образованию активного гормона инсулина (см. Сахарный диабет).
Прежде всего соответствующая пептидаза отщепляет сигнальный пептид (1). Фермент узнает точку расщепления в составе специфической N-концевой последовательности белка.
Путём окисления боковых цепей цистеина образуются дисульфидные мостики, правильность положения которых контролируется протеиндисульфидизомеразой (2).
Пептидилпролил-изомераза контролирует цис-транс-изомеризацию X-Pro-связей в синтезируемом пептиде (3).
Трансгликозидазы переносят олигосахариды в блоке с долихолом (длинноцепочечным изопреноидом) на определённые остатки аспарагиновой кислоты в белке, тем самым осуществляя N-гликозилирование белка (4).
Гликозидазы «подстригают» олигосахариды, отщепляя избыточные остатки глюкозы и маннозы (5).
Для того чтобы растущая полипептидная цепь могла свернуться необходимым образом, с ещё линейным участком цепи временно связываются шапероны (6). Эти белки направляют процесс свёртывания цепи путём подавления нежелательных побочных взаимодействий. Наиболее важным шапероном, присутствующим в просвете ШЭР, является белок связывания (BiP, от англ. binding protein). Когда вновь образованный белок приобретает правильную вторичную и третичную структуру и остатки глюкозы удалены полностью, он с помощью транспортных везикул перемещается в аппарат Гольджи (см. Транслокация белков. Шапероны).
Модификации в аппарате Гольджи. В аппарате Гольджи осуществляются следующие ферментативные стадии модификации белка: фосфорилирование (7) и отщепление с последующим переносом (перегруппировка) остатков сахаров с помощью гликозидаз и гликозилтрансфераз (8). Эта модификация имеет целью образование специфической олигосахаридной структуры в гликопротеинах.
Наконец, в секреторных пузырьках (везикулах) отщепляется ещё один пептид (9), прежде чем содержимое секретируется посредством экзоцитоза. Это отщепление, катализируемое специфичными пептидазами, выполняет функцию активации секретируемого белка. Например, отщепление C-пептида от неактивного проинсулина приводит к образованию активного гормона инсулина (см. Сахарный диабет).
Статьи раздела «Синтез белка и его созревание»:
- А. Синтез белка в шероховатом эндоплазматическом ретикулуме
- Б. Модификация белков
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Планета вирусов
Планета вирусов Вирусы — невидимые, но активные участники борьбы за место в биосфере Земли. С их ...
В монографии д.б.н., в.н.с. ИБК РАН Н.Л.Векшина на примере актиномицинов ...
Автор ставил себе задачей в этой небольшой книге осветить биохимическую сторону ...
 Фотосинтез: физико-химический подход
Фотосинтез: физико-химический подход Подробно обосновывается предложенная автором (1995) принципиально новая концепция ...