Определённые сочетания двугранных углов φ и ψ (см. Гликолиз) встречаются в белках довольно часто. Если множество последовательно связанных аминокислотных остатков принимает стандартные конформации, формируются вторичные структуры, стабилизированные водородными мостиками в пределах одной пептидной цепи или между соседними цепями. Если такая регулярная структура распространяется на достаточно большой фрагмент молекулы белка, такой белок образует механически прочные нити или волокна. Подобного рода структурные белки (см. Структурные белки) имеют характерный аминокислотный состав.
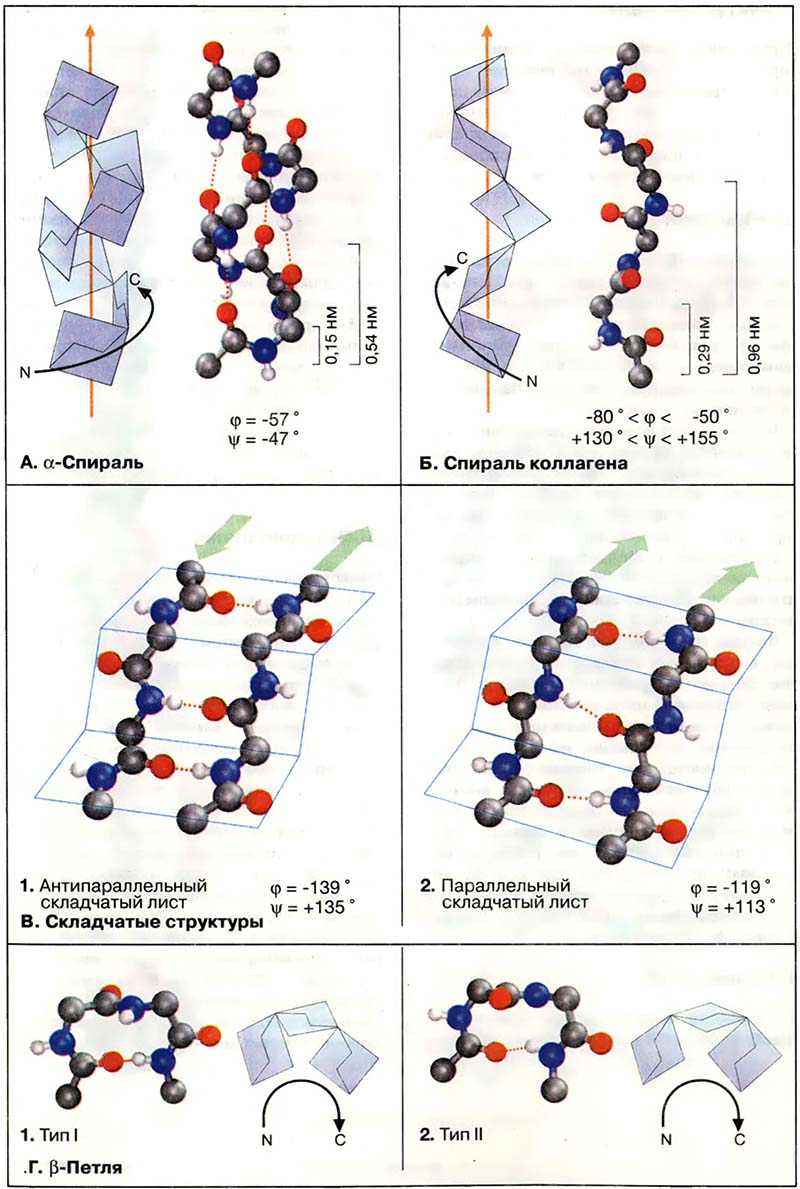
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишённый боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1.
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишённый боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1.
Статьи раздела «Вторичные структуры белков»:
- Вторичные структуры белков
- А. α-Спираль
- Б. Спираль коллагена
- В. Складчатые структуры
- Г. β-Петля
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
В книге собраны лучшие из современных методов выделения и анализа важнейшего ...
 Планета вирусов
Планета вирусов Вирусы — невидимые, но активные участники борьбы за место в биосфере Земли. С их ...
 Введение в биофизическую химию
Введение в биофизическую химию Книга представляет собой руководство по биофизической химии, в котором кратко и ...