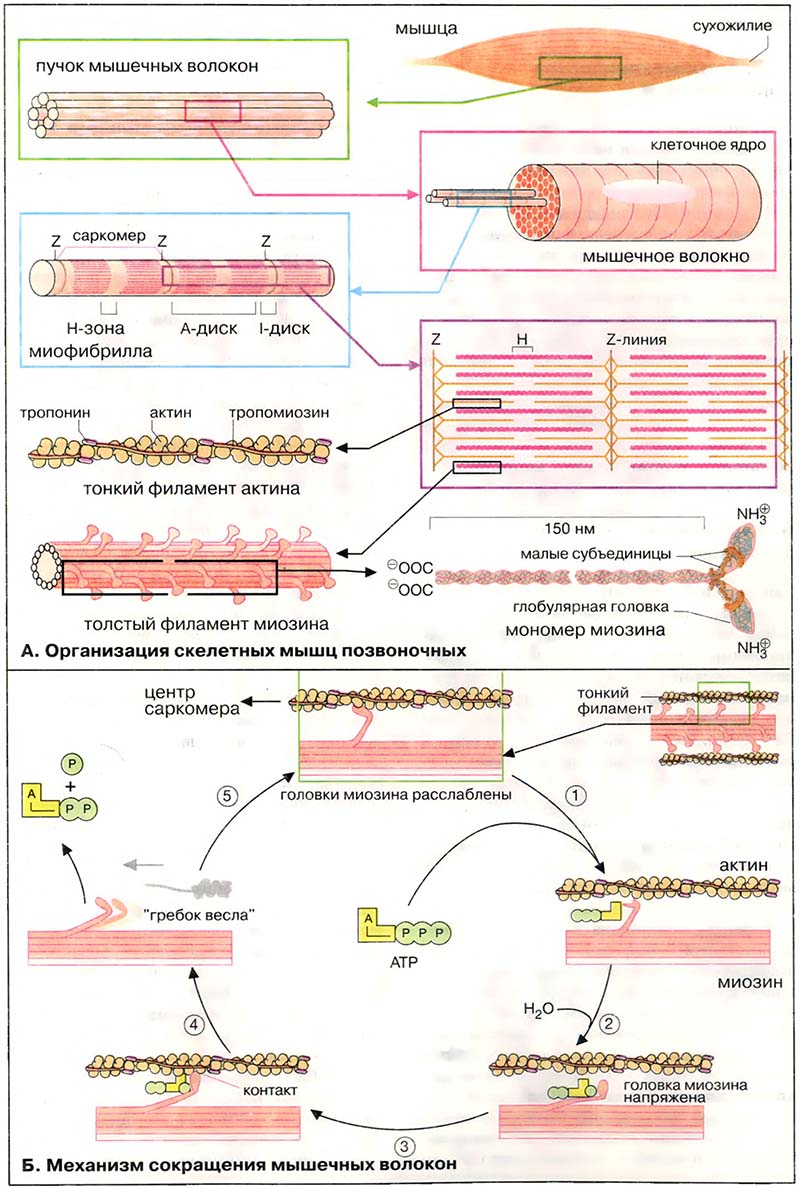
Скелетные поперечнополосатые мышцы позвоночных состоят из параллельных пучков мышечных волокон. Каждое волокно представляет собой одну большую многоядерную клетку. Большую часть объёма мышечных клеток занимают миофибриллы толщиной 1-2 мкм, простирающиеся на всю длину мышечного волокна. Поперечная исчерченность, характерная для миофибрилл скелетных мышц, связана с чередованием различных по толщине молекул.
Сократительные элементы, саркомеры, состоят из двух типов параллельных нитей, толстых филаментов миозина и тонких филаментов F-актина (см. Клеточные компоненты и цитоплазма). Крайние, более тёмные области A-дисков содержат как тонкие, так и толстые нити, тогда как центральная часть, Н-зона, содержит только нити миозина. Z-Линии (или Z-пластинки) соответствуют тем участкам, где тонкие нити крепятся к так называемым Z-дискам. Саркомером называется продольная единица, ограниченная двумя Z-линиями.
В количественном отношении наиболее важным белком миофибрилл является миозин (~65 % мышечного белка). Молекула миозина построена из шести субъединиц, двух идентичных тяжёлых цепей (2 × 223 кДа) и четырёх лёгких цепей (-20 кДа), связанных нековалентно. Каждая тяжёлая цепь миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа). α-Спиральные участки двух тяжёлых цепей свёрнуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно. Головка молекулы миозина обладает Ca2+-зависимой АТФ-азной активностью (КФ 3.6.1.32), которая регулируется малыми субъединицами.
Главным белком тонких нитей является актин (42 кДа, −20-25 % мышечного белка). Фибриллярный F-актин является важным структурным элементом цитоскелета; он находится в равновесии с глобулярным G-актином.
Кроме этих двух белков система включает тропомиозин и комплекс тропонина. Нитевидный тропомиозин (64 кДа) связан с F-актином, охватывая примерно семь актиновых субъединиц. Тропонин (78 кДа) — комплекс, состоящий из трёх различных субъединиц (Т, C, I), способен связываться как с актином, так и с тропомиозином. Остальные белки, присутствующие в гораздо меньшем количестве, включают α- и β-актинин, десмин, коннектин (титин) и виментин.
Сократительные элементы, саркомеры, состоят из двух типов параллельных нитей, толстых филаментов миозина и тонких филаментов F-актина (см. Клеточные компоненты и цитоплазма). Крайние, более тёмные области A-дисков содержат как тонкие, так и толстые нити, тогда как центральная часть, Н-зона, содержит только нити миозина. Z-Линии (или Z-пластинки) соответствуют тем участкам, где тонкие нити крепятся к так называемым Z-дискам. Саркомером называется продольная единица, ограниченная двумя Z-линиями.
В количественном отношении наиболее важным белком миофибрилл является миозин (~65 % мышечного белка). Молекула миозина построена из шести субъединиц, двух идентичных тяжёлых цепей (2 × 223 кДа) и четырёх лёгких цепей (-20 кДа), связанных нековалентно. Каждая тяжёлая цепь миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа). α-Спиральные участки двух тяжёлых цепей свёрнуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно. Головка молекулы миозина обладает Ca2+-зависимой АТФ-азной активностью (КФ 3.6.1.32), которая регулируется малыми субъединицами.
Главным белком тонких нитей является актин (42 кДа, −20-25 % мышечного белка). Фибриллярный F-актин является важным структурным элементом цитоскелета; он находится в равновесии с глобулярным G-актином.
Кроме этих двух белков система включает тропомиозин и комплекс тропонина. Нитевидный тропомиозин (64 кДа) связан с F-актином, охватывая примерно семь актиновых субъединиц. Тропонин (78 кДа) — комплекс, состоящий из трёх различных субъединиц (Т, C, I), способен связываться как с актином, так и с тропомиозином. Остальные белки, присутствующие в гораздо меньшем количестве, включают α- и β-актинин, десмин, коннектин (титин) и виментин.
Статьи раздела «Сократительная система»:
- А. Организация скелетных мышц позвоночных
- Б. Механизм сокращения мышечных волокон
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Фотосинтез: физико-химический подход
Фотосинтез: физико-химический подход Подробно обосновывается предложенная автором (1995) принципиально новая концепция ...
Металлы, находящиеся в незначительных количествах внутри живого организма, ...
 Введение в молекулярную биологию
Введение в молекулярную биологию Задача предлагаемой книги состоит в ознакомлении читателей с важнейшими фактами ...
 Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition)
Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition) The Third Edition of Microbiology with Diseases by Taxonomy is the most cutting-edge microbiology book available, offering unparalleled currency, ...