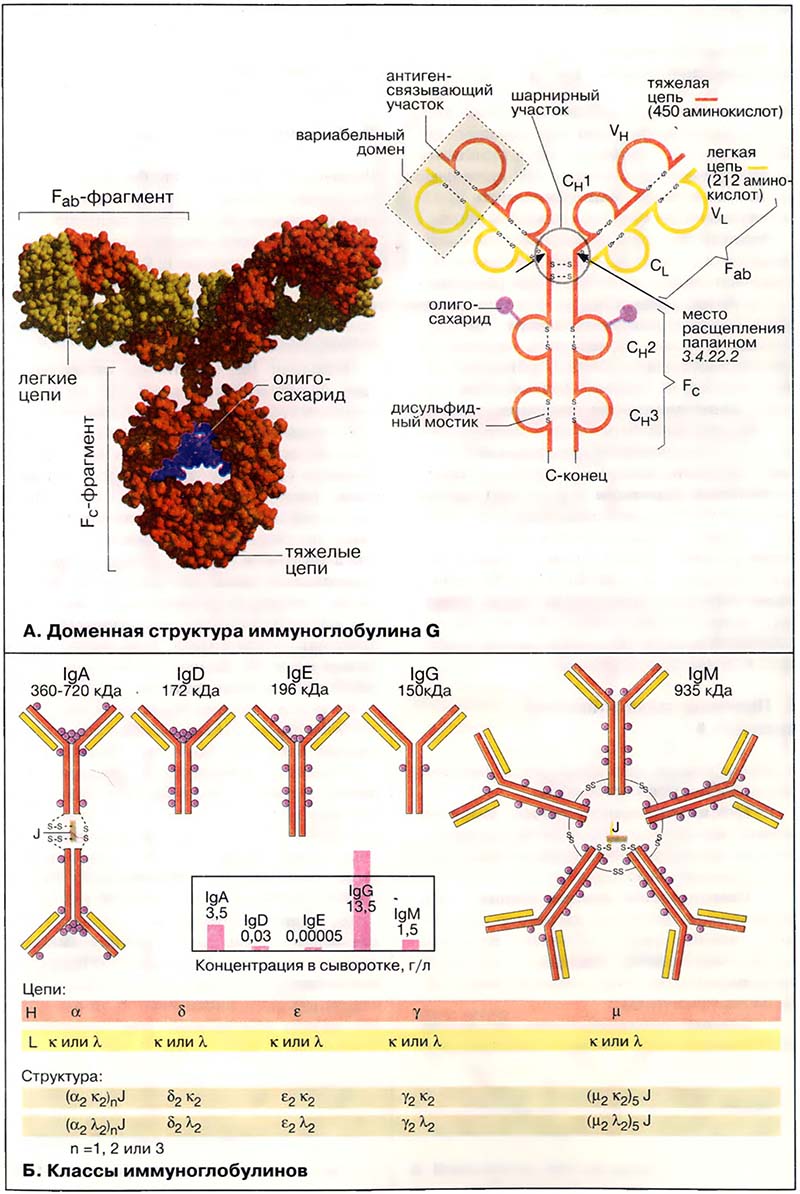
Иммуноглобулины (Ig), или антитела, являются семейством Y-образных (по пространственной структуре) гликопротеинов, у которых обе вершины («буквы Y») могут связывать антиген. Иммуноглобулины находятся в виде мембранных белков на поверхности лимфоцитов и в свободном виде в плазме крови. На схеме показана структура наиболее важного из них — иммуноглобулина класса G (IgG). Молекула представляет собой крупный тетрамер (H2L2 с 150 кДа) из двух идентичных тяжёлых цепей (Н-цепей, на схеме красного или оранжевого цвета) и двух идентичных лёгких цепей (L-цепей, на схеме жёлтого цвета). В обеих Н-цепях имеется ковалентно связанный олигосахарид (на схеме фиолетового цвета; см. также Окислительно-восстановительные коферменты).
Иммуноглобулины расщепляются протеиназой папаином на два Fab-фрагмента и один Fc-фрагмент. Оба Fab-фрагмента (от англ. antigen binding fragment — антиген-связывающий фрагмент) состоят соответственно из одной L-цепи и N-концевой части Н-цепи. Изолированные Fab-фрагменты сохраняют способность связывать антиген. Fc-Фрагмент (от англ. fragment crystallizable — способный кристаллизоваться) состоит из C-концевой половины обеих Н-цепей. Эта часть IgG выполняет функции связывания с клеточной поверхностью, взаимодействия с системой комплемента и участвует в переносе антител клетками.
Несмотря на большое разнообразие в иммуноглобулинах соблюдается общий принцип строения. Обе тяжёлые пептидные цепи (Н-цепи) IgG состоят из четырёх глобулярных доменов VH, Cн1, Cн2 и Сн3, обе лёгкие (L- цепи) — из двух глобулярных доменов CL и VL. При этом буквы C и V соответственно обозначают константные (англ. constant) и вариабельные (англ. variable) области. Обе тяжёлые цепи, а также тяжёлая цепь с лёгкой, связаны дисульфидными мостиками. Дисульфидные мостики внутри доменов стабилизируют третичную структуру. Домены имеют длину около 110 аминокислот и обладают взаимной гомологией (см. Белки главного комплекса гисто-совместимости). Такая структура антител, очевидно, возникла благодаря дубликации гена.
В центральной области молекул иммуноглобулинов расположен шарнирный участок, который придаёт антителам внутримолекулярную подвижность.
Иммуноглобулины расщепляются протеиназой папаином на два Fab-фрагмента и один Fc-фрагмент. Оба Fab-фрагмента (от англ. antigen binding fragment — антиген-связывающий фрагмент) состоят соответственно из одной L-цепи и N-концевой части Н-цепи. Изолированные Fab-фрагменты сохраняют способность связывать антиген. Fc-Фрагмент (от англ. fragment crystallizable — способный кристаллизоваться) состоит из C-концевой половины обеих Н-цепей. Эта часть IgG выполняет функции связывания с клеточной поверхностью, взаимодействия с системой комплемента и участвует в переносе антител клетками.
Несмотря на большое разнообразие в иммуноглобулинах соблюдается общий принцип строения. Обе тяжёлые пептидные цепи (Н-цепи) IgG состоят из четырёх глобулярных доменов VH, Cн1, Cн2 и Сн3, обе лёгкие (L- цепи) — из двух глобулярных доменов CL и VL. При этом буквы C и V соответственно обозначают константные (англ. constant) и вариабельные (англ. variable) области. Обе тяжёлые цепи, а также тяжёлая цепь с лёгкой, связаны дисульфидными мостиками. Дисульфидные мостики внутри доменов стабилизируют третичную структуру. Домены имеют длину около 110 аминокислот и обладают взаимной гомологией (см. Белки главного комплекса гисто-совместимости). Такая структура антител, очевидно, возникла благодаря дубликации гена.
В центральной области молекул иммуноглобулинов расположен шарнирный участок, который придаёт антителам внутримолекулярную подвижность.
Статьи раздела «Антитела»:
- А. Доменная структура иммуноглобулина G
- Б. Классы иммуноглобулинов
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Handbook of Nanoindentation: With Biological Applications
Handbook of Nanoindentation: With Biological Applications Broadly divided into two parts, this guide’s first part presents the a’basic sciencea’ of nanoindentation, including the background of contact ...
Авторы монографии поставили перед собой задачу отобрать наиболее достоверные и ...
 NMR Studies of Structural Motifs: Protein Folding and Ligand Binding
NMR Studies of Structural Motifs: Protein Folding and Ligand Binding NMR of Structural Motifs: The agrin G3 domain is critical in development and maintenance of the neuromuscular junction. G3 binds -dystroglycan and ...
