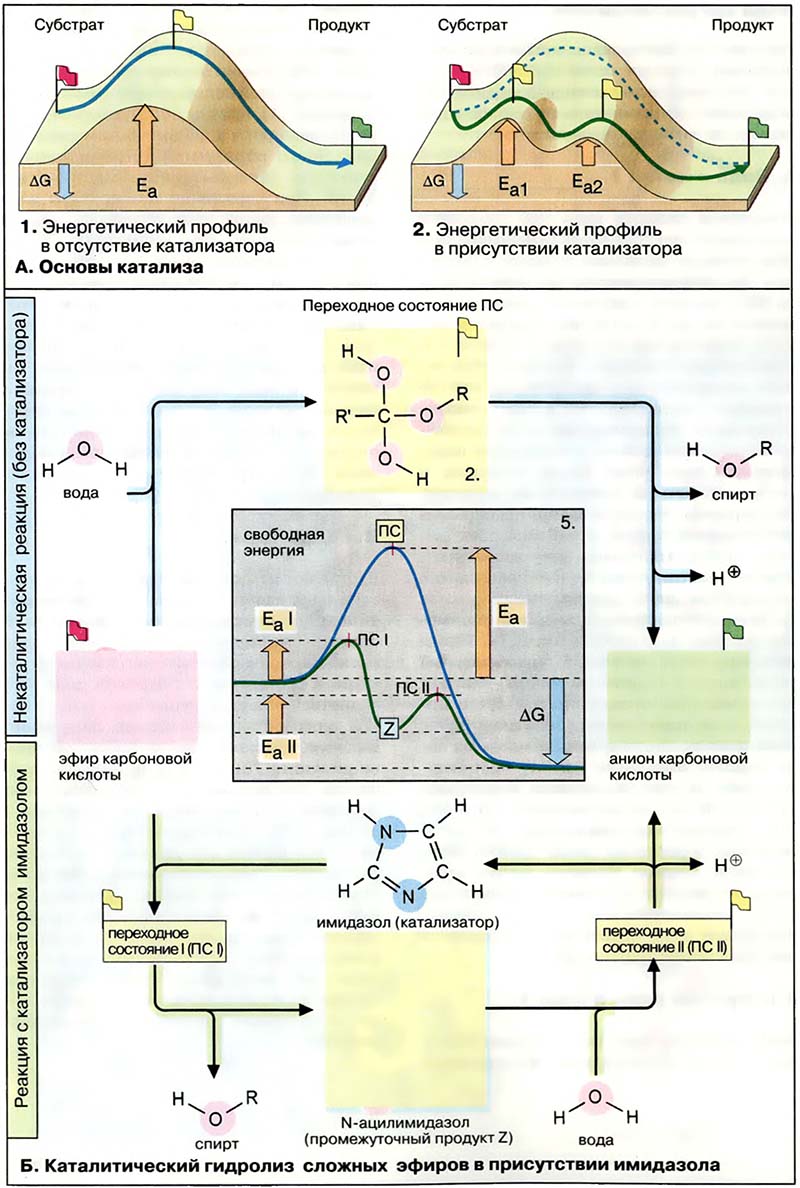
В качестве простого примера рассмотрим гидролиз эфиров карбоновых кислот. В отсутствие катализатора (верхняя часть схемы Б) речь идёт о нуклеофильном замещении (см. Растительные полисахариды). В качестве нуклеофильного заместителя выступает атом кислорода молекул воды, местом атаки является C-атом карбонильной группы (1), который из-за сильной поляризации двойной связи имеет частичный положительный заряд (см. Кислоты и основания). На первой стадии образуется нестабильное тетраэдрическое переходное состояние (2); на второй стадии элиминируется молекула спирта и образуется анион карбоновой кислоты (3). Большинство реакций замещения, представляющих биохимический интерес, протекают по аналогичному механизму присоединения — элиминирования.
Несмотря на то, что ΔG в данном случае величина отрицательная, гидролиз сложных эфиров в воде идёт с низкой скоростью, поскольку вода обладает слабыми нуклеофильными свойствами. В щелочной области pH гидролиз идёт гораздо быстрее, поскольку в этом случае в реакции принимает участие сильный нуклеофил — OH-ионы. Однако реакцию при нейтральных значениях pH можно ускорить, если в среду добавить основание, например имидазол. Катализируемая имидазолом реакция (нижняя часть схемы Б), протекает в две стадии. На первой стадии в роли нуклеофильного реагента выступает молекула самого катализатора. В качестве относительно стабильного промежуточного продукта образуется N-ацилимидазол. На второй стадии идёт гидролиз промежуточного продукта. При этом, как и в первом случае, образуется анион карбоновой кислоты и высвобождается молекула катализатора. Энергетическая диаграмма показывает, что энергия активации промежуточных реакций существенно ниже по сравнению с реакцией в отсутствие катализатора. Поэтому гидролиз сложного эфира ускоряется в присутствии имидазола. Как и в случае ферментативного катализа (см. Кинетика ферментативных реакций), скорость катализируемой реакции пропорциональна концентрации катализатора.
Несмотря на то, что ΔG в данном случае величина отрицательная, гидролиз сложных эфиров в воде идёт с низкой скоростью, поскольку вода обладает слабыми нуклеофильными свойствами. В щелочной области pH гидролиз идёт гораздо быстрее, поскольку в этом случае в реакции принимает участие сильный нуклеофил — OH-ионы. Однако реакцию при нейтральных значениях pH можно ускорить, если в среду добавить основание, например имидазол. Катализируемая имидазолом реакция (нижняя часть схемы Б), протекает в две стадии. На первой стадии в роли нуклеофильного реагента выступает молекула самого катализатора. В качестве относительно стабильного промежуточного продукта образуется N-ацилимидазол. На второй стадии идёт гидролиз промежуточного продукта. При этом, как и в первом случае, образуется анион карбоновой кислоты и высвобождается молекула катализатора. Энергетическая диаграмма показывает, что энергия активации промежуточных реакций существенно ниже по сравнению с реакцией в отсутствие катализатора. Поэтому гидролиз сложного эфира ускоряется в присутствии имидазола. Как и в случае ферментативного катализа (см. Кинетика ферментативных реакций), скорость катализируемой реакции пропорциональна концентрации катализатора.
Статьи раздела «Катализ»:
- Катализ
- А. Основы катализа
- Б. Каталитический гидролиз сложных эфиров в присутствии имидазола
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
В книге собраны лучшие из современных методов выделения и анализа важнейшего ...
As the title suggests, Isotope Effects in the Chemical, Geological and Bio Sciences deals with differences in the properties of isotopically ...
 Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation
Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation A novel role of TCF family in body axis formation. Revolutionary high impact discoveries are described, elucidating the missing link in the Wnt ...
В книге обобщён большой опыт, накопленный за последние годы в области применения ...