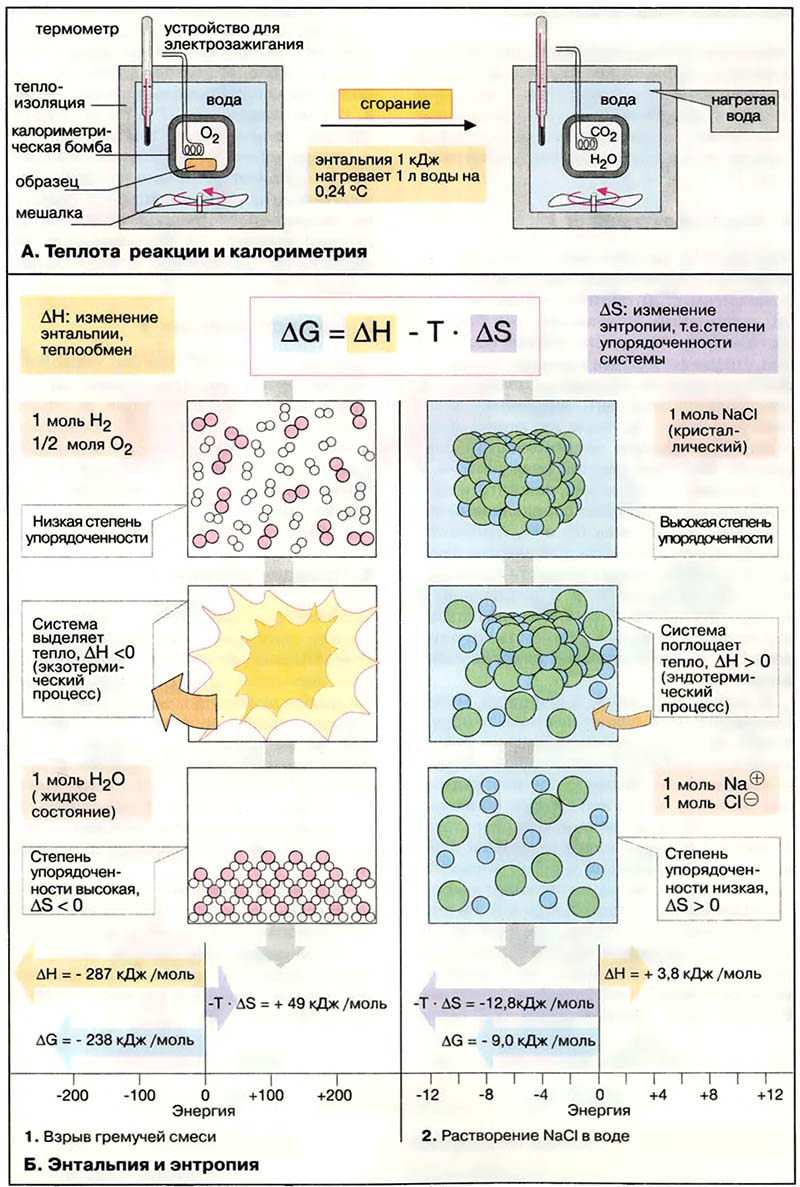
Теплота реакции ΔH и изменение свободной энергии ΔG не всегда имеют сравнимые значения. В действительности известны реакции, протекающие спонтанно (ΔG меньше 0) несмотря на то, что являются эндотермическими (ΔH больше 0). Это происходит потому, что на прохождение реакции оказывает влияние изменение степени упорядоченности системы. Мерой изменения упорядоченности системы служит изменение энтропии ΔS.
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идёт в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS больше 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца:
ΔG = ΔН — Т×ΔS
Поясним зависимость этих трёх величин на двух примерах.
Взрыв гремучей смеси (1) — это взаимодействие двух газов — кислорода и водорода — с образованием воды. Как и многие окислительно-восстановительные реакции (см. Окислительно-восстановительные процессы), это сильно экзотермический процесс (т. е. ΔН меньше 0). В то же время в результате реакции возрастает степень упорядоченности системы. Газ с его хаотически мигрирующими молекулами перешёл в более упорядоченное состояние — жидкую фазу, при этом число молекул в системе уменьшилось на 1/3. В результате увеличения степени упорядоченности (ΔS меньше 0) член уравнения — Т×ΔS — величина положительная, однако это с избытком компенсируется ростом энтальпии: в итоге происходит высоко экзергоническая реакция (ΔG меньше 0).
При растворении в воде поваренной соли (2) ΔH — величина положительная, температура в сосуде с раствором, т. е. в объёме раствора, снижается. Тем не менее процесс идёт спонтанно, поскольку степень упорядоченности системы уменьшается. В исходном состоянии ионы Na+ и Cl- занимали фиксированные положения в кристаллической решётке. В растворе они перемещаются независимо друг от друга в произвольных направлениях. Снижение упорядоченности (ΔS меньше 0) означает, что член уравнения — Т×ΔS имеет знак минус. Это компенсирует ΔH и в целом ΔG — величина отрицательная. Подобные процессы принято называть энтропийными.
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идёт в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS больше 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца:
ΔG = ΔН — Т×ΔS
Поясним зависимость этих трёх величин на двух примерах.
Взрыв гремучей смеси (1) — это взаимодействие двух газов — кислорода и водорода — с образованием воды. Как и многие окислительно-восстановительные реакции (см. Окислительно-восстановительные процессы), это сильно экзотермический процесс (т. е. ΔН меньше 0). В то же время в результате реакции возрастает степень упорядоченности системы. Газ с его хаотически мигрирующими молекулами перешёл в более упорядоченное состояние — жидкую фазу, при этом число молекул в системе уменьшилось на 1/3. В результате увеличения степени упорядоченности (ΔS меньше 0) член уравнения — Т×ΔS — величина положительная, однако это с избытком компенсируется ростом энтальпии: в итоге происходит высоко экзергоническая реакция (ΔG меньше 0).
При растворении в воде поваренной соли (2) ΔH — величина положительная, температура в сосуде с раствором, т. е. в объёме раствора, снижается. Тем не менее процесс идёт спонтанно, поскольку степень упорядоченности системы уменьшается. В исходном состоянии ионы Na+ и Cl- занимали фиксированные положения в кристаллической решётке. В растворе они перемещаются независимо друг от друга в произвольных направлениях. Снижение упорядоченности (ΔS меньше 0) означает, что член уравнения — Т×ΔS имеет знак минус. Это компенсирует ΔH и в целом ΔG — величина отрицательная. Подобные процессы принято называть энтропийными.
Статьи раздела «Энтальпия и энтропия»:
- Энтальпия и энтропия
- А. Теплота реакции и калориметрия
- Б. Энтальпия и энтропия
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 История биологической химии. Истоки науки
История биологической химии. Истоки науки Книга посвящена первым шагам взаимодействия химии с биологией и медициной. В ней ...
Авторы монографии поставили перед собой задачу отобрать наиболее достоверные и ...
 Биофизическая химия (комплект из 2 книг)
Биофизическая химия (комплект из 2 книг) В трёхтомном издании, написанном учёными из США, на самом современном уровне ...