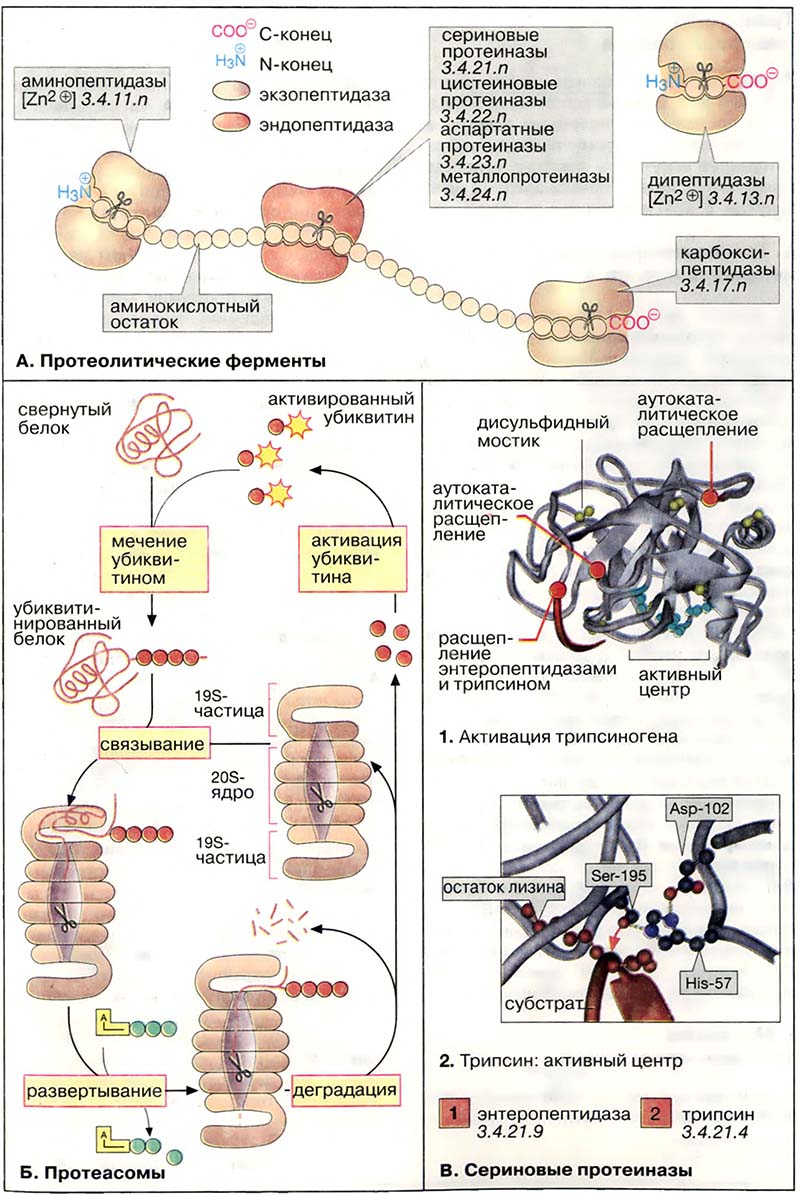
Поскольку функциональные белки клетки должны быть защищены от преждевременного протеолиза, часть протеолитических ферментов клетки заключена в липосомы (см. Лизосомы). Другая хорошо регулируемая система деградации белков локализована в цитоплазме. Она состоит из больших белковых комплексов (молекулярная масса 2×106 Да), протеасом. Протеасомы содержат бочковидное ядро из 28 субъединиц и имеют коэффициент седиментации (см. Центрифугирование) 20S. Протеолитическая активность (на схеме показана в виде ножниц) локализована во внутреннем 208-ядре. С торцов бочки запираются сложно устроенными 19S-частицами, контролирующими доступ в ядро.
Белки, которым предстоит разрушение в протеасоме (например, содержащие ошибки транскрипции или состарившиеся молекулы), метятся путём ковалентного связывания с небольшим белком убиквитином. Убиквитин активирован благодаря наличию тиолсложноэфирной связи. Меченые убиквитином («убиквитинированные») молекулы распознаются 19S-частицами с потреблением АТФ и попадают в ядро, где происходит их деградация. Убиквитин не разрушается и после активации используется вновь
Белки, которым предстоит разрушение в протеасоме (например, содержащие ошибки транскрипции или состарившиеся молекулы), метятся путём ковалентного связывания с небольшим белком убиквитином. Убиквитин активирован благодаря наличию тиолсложноэфирной связи. Меченые убиквитином («убиквитинированные») молекулы распознаются 19S-частицами с потреблением АТФ и попадают в ядро, где происходит их деградация. Убиквитин не разрушается и после активации используется вновь
Статьи раздела «Протеолиз»:
- А. Протеолитические ферменты
- Б. Протеасомы
- В. Сериновые протеиназы
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 NMR Studies of Structural Motifs: Protein Folding and Ligand Binding
NMR Studies of Structural Motifs: Protein Folding and Ligand Binding NMR of Structural Motifs: The agrin G3 domain is critical in development and maintenance of the neuromuscular junction. G3 binds -dystroglycan and ...
 Математические модели морфогенеза
Математические модели морфогенеза Автором предлагаемого курса лекций по математическим моделям морфогенеза ...
 Молекулярные механизмы взаимодействия эндотоксинов с клетками-мишенями
Молекулярные механизмы взаимодействия эндотоксинов с клетками-мишенями Открытие истинных рецепторов к эндотоксинам (липополисахаридам), сделанное на ...
 Защита от биоповреждений, вызываемых грибами
Защита от биоповреждений, вызываемых грибами Книга посвящена проблеме снижения химической и биологической опасности в сфере ...