Химические свойства элементов и типы связей, которые они могут образовывать, определяются строением электронной оболочки атомов. На схеме А приведены электронные конфигурации химических элементов. Объяснение символов и сокращений дано на схеме Б. Более детально вопросы строения атомов обсуждаются в учебниках по химии.
Возможные состояния электронов определяются различными энергетическими подуровнями, которые носят название орбиталей. Орбитали характеризуются главным квантовым числом и обозначаются буквами s, р или d. Орбитали заполняются последовательно, одна за другой, по мере увеличения числа электронов. На каждой орбитали могут располагаться только два электрона, которые должны иметь противоположно направленные, антипараллельные, спины (↓ и ↑ соответственно). На схеме А приведено распределение электронов на орбиталях для ряда химических элементов. Например, 6 электронов углерода (1) занимают 1s-, 2s- и 2р-орбитали. Заполненная 1s-орбиталь имеет электронную конфигурацию инертного газа гелия (He). На схемах А и Б эта область электронной оболочки углерода обозначена знаком He; в правом столбце рядом с химическим знаком на схеме А указаны электроны, занимающие другие заполненные орбитали (2s и 2p в случае углерода). Электронная оболочка атома хлора (2) состоит из оболочки инертного газа неона (Ne) и семи дополнительных электронов, занимающих 3s- и Зp-орбитали.
В атоме железа (3), переходном металле первой побочной группы, электроны занимают 4s-орбиталь, при этом 3d-орбитали остаются незаполненными. Многие реакции переходных металлов, например реакции комплексообразования с основаниями, окислительно-восстановительные реакции, проходят с участием незаполненных d-орбиталей.
Возможные состояния электронов определяются различными энергетическими подуровнями, которые носят название орбиталей. Орбитали характеризуются главным квантовым числом и обозначаются буквами s, р или d. Орбитали заполняются последовательно, одна за другой, по мере увеличения числа электронов. На каждой орбитали могут располагаться только два электрона, которые должны иметь противоположно направленные, антипараллельные, спины (↓ и ↑ соответственно). На схеме А приведено распределение электронов на орбиталях для ряда химических элементов. Например, 6 электронов углерода (1) занимают 1s-, 2s- и 2р-орбитали. Заполненная 1s-орбиталь имеет электронную конфигурацию инертного газа гелия (He). На схемах А и Б эта область электронной оболочки углерода обозначена знаком He; в правом столбце рядом с химическим знаком на схеме А указаны электроны, занимающие другие заполненные орбитали (2s и 2p в случае углерода). Электронная оболочка атома хлора (2) состоит из оболочки инертного газа неона (Ne) и семи дополнительных электронов, занимающих 3s- и Зp-орбитали.
В атоме железа (3), переходном металле первой побочной группы, электроны занимают 4s-орбиталь, при этом 3d-орбитали остаются незаполненными. Многие реакции переходных металлов, например реакции комплексообразования с основаниями, окислительно-восстановительные реакции, проходят с участием незаполненных d-орбиталей.
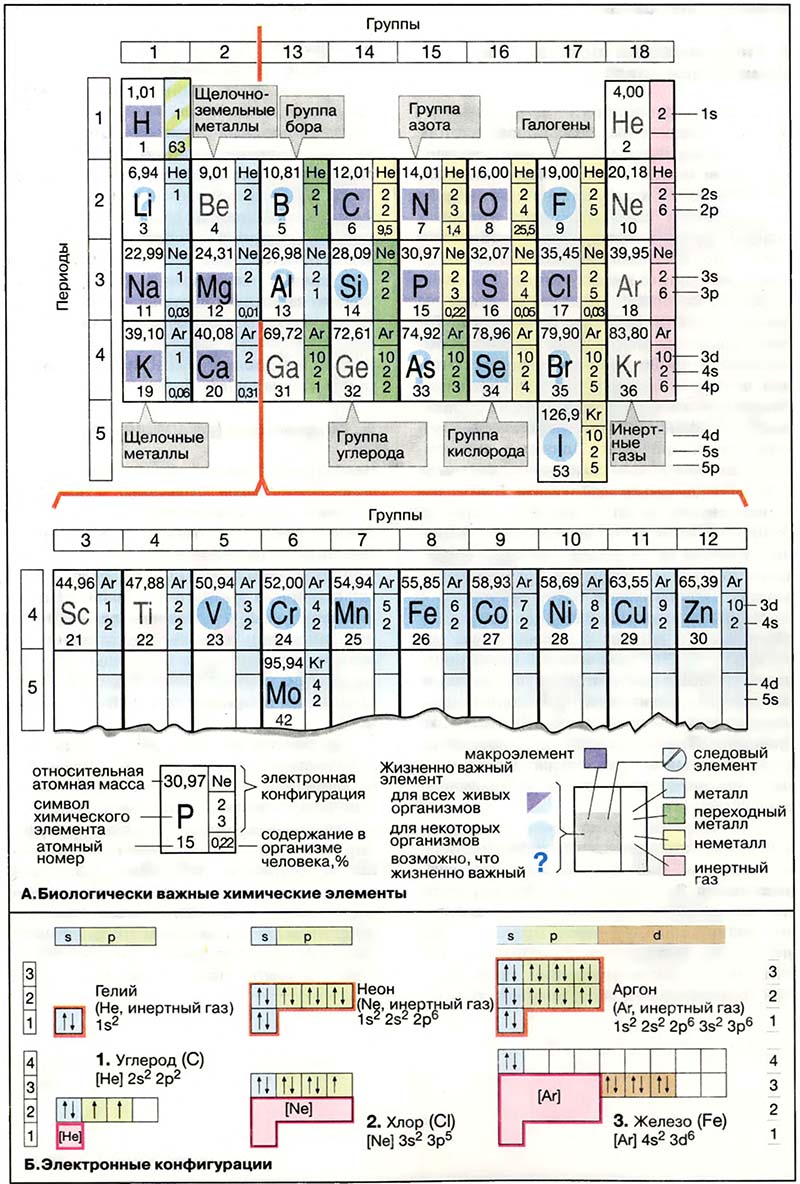
Статьи раздела «Периодическая система элементов Д. И. Менделеева»:
- А. Биологически важные химические элементы
- Б. Электронные конфигурации
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Объекты биологии развития
Объекты биологии развития Монография представляет собой вторую книгу из серии «Проблемы биологии ...
В книге собраны лучшие из современных методов выделения и анализа важнейшего ...
 Откровенная наука. Беседы с корифеями биохимии и медицинской химии
Откровенная наука. Беседы с корифеями биохимии и медицинской химии Книга И. Харгиттаи состоит из 36 бесед с выдающимися учёными XX века, работавшими в ...
To harness the high-throughput potential of DNA microarray technology, it is crucial that the analysis stages of the process are decoupled from the ...