Химические свойства элементов и типы связей, которые они могут образовывать, определяются строением электронной оболочки атомов. На схеме А приведены электронные конфигурации химических элементов. Объяснение символов и сокращений дано на схеме Б. Более детально вопросы строения атомов обсуждаются в учебниках по химии.
Возможные состояния электронов определяются различными энергетическими подуровнями, которые носят название орбиталей. Орбитали характеризуются главным квантовым числом и обозначаются буквами s, р или d. Орбитали заполняются последовательно, одна за другой, по мере увеличения числа электронов. На каждой орбитали могут располагаться только два электрона, которые должны иметь противоположно направленные, антипараллельные, спины (↓ и ↑ соответственно). На схеме А приведено распределение электронов на орбиталях для ряда химических элементов. Например, 6 электронов углерода (1) занимают 1s-, 2s- и 2р-орбитали. Заполненная 1s-орбиталь имеет электронную конфигурацию инертного газа гелия (He). На схемах А и Б эта область электронной оболочки углерода обозначена знаком He; в правом столбце рядом с химическим знаком на схеме А указаны электроны, занимающие другие заполненные орбитали (2s и 2p в случае углерода). Электронная оболочка атома хлора (2) состоит из оболочки инертного газа неона (Ne) и семи дополнительных электронов, занимающих 3s- и Зp-орбитали.
В атоме железа (3), переходном металле первой побочной группы, электроны занимают 4s-орбиталь, при этом 3d-орбитали остаются незаполненными. Многие реакции переходных металлов, например реакции комплексообразования с основаниями, окислительно-восстановительные реакции, проходят с участием незаполненных d-орбиталей.
Возможные состояния электронов определяются различными энергетическими подуровнями, которые носят название орбиталей. Орбитали характеризуются главным квантовым числом и обозначаются буквами s, р или d. Орбитали заполняются последовательно, одна за другой, по мере увеличения числа электронов. На каждой орбитали могут располагаться только два электрона, которые должны иметь противоположно направленные, антипараллельные, спины (↓ и ↑ соответственно). На схеме А приведено распределение электронов на орбиталях для ряда химических элементов. Например, 6 электронов углерода (1) занимают 1s-, 2s- и 2р-орбитали. Заполненная 1s-орбиталь имеет электронную конфигурацию инертного газа гелия (He). На схемах А и Б эта область электронной оболочки углерода обозначена знаком He; в правом столбце рядом с химическим знаком на схеме А указаны электроны, занимающие другие заполненные орбитали (2s и 2p в случае углерода). Электронная оболочка атома хлора (2) состоит из оболочки инертного газа неона (Ne) и семи дополнительных электронов, занимающих 3s- и Зp-орбитали.
В атоме железа (3), переходном металле первой побочной группы, электроны занимают 4s-орбиталь, при этом 3d-орбитали остаются незаполненными. Многие реакции переходных металлов, например реакции комплексообразования с основаниями, окислительно-восстановительные реакции, проходят с участием незаполненных d-орбиталей.
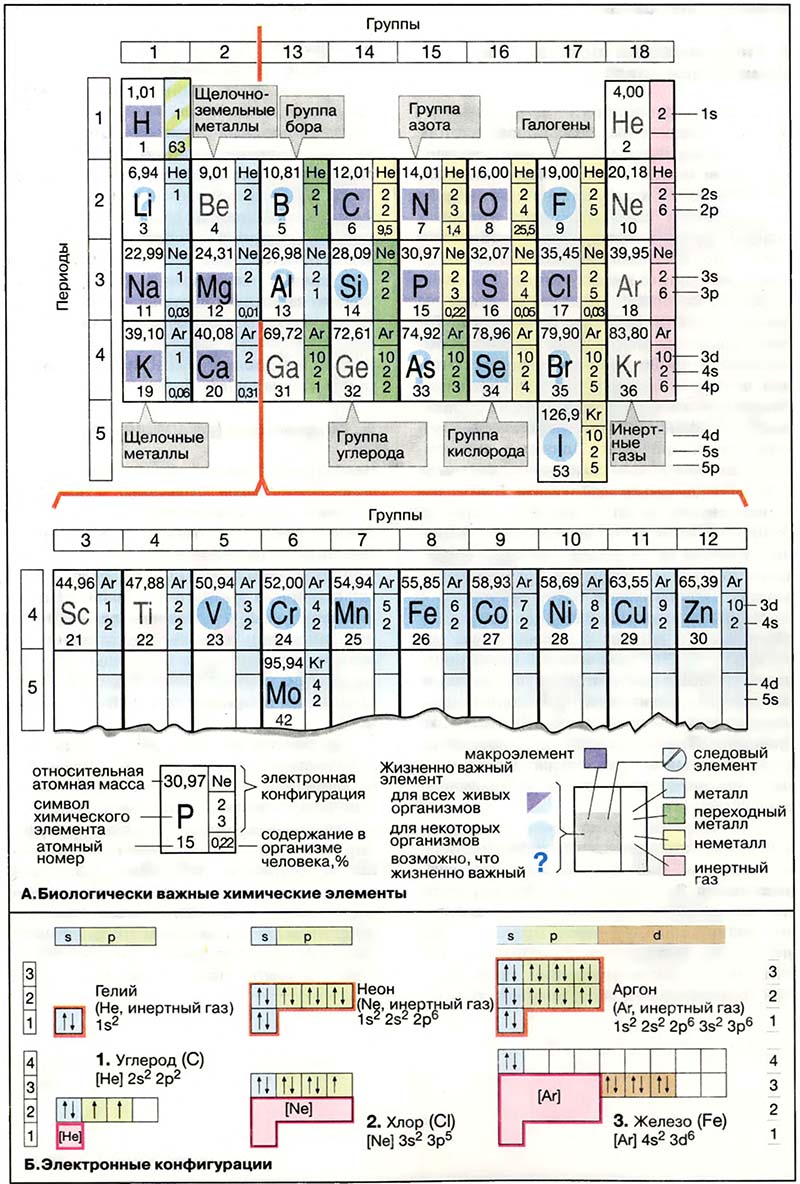
Статьи раздела «Периодическая система элементов Д. И. Менделеева»:
- А. Биологически важные химические элементы
- Б. Электронные конфигурации
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Principles of Biomedical Informatics
Principles of Biomedical Informatics Biomedical informatics (BMI) is an extraordinarily broad discipline. In scale, it spans across genes, cells, tissues, organ systems, individual ...
Авторы монографии поставили перед собой задачу отобрать наиболее достоверные и ...
 Структура и стабильность биологических макромолекул
Структура и стабильность биологических макромолекул В книге рассмотрены строение и свойства биополимеров — в основном белков. Такие ...
 Математические модели морфогенеза
Математические модели морфогенеза Автором предлагаемого курса лекций по математическим моделям морфогенеза ...