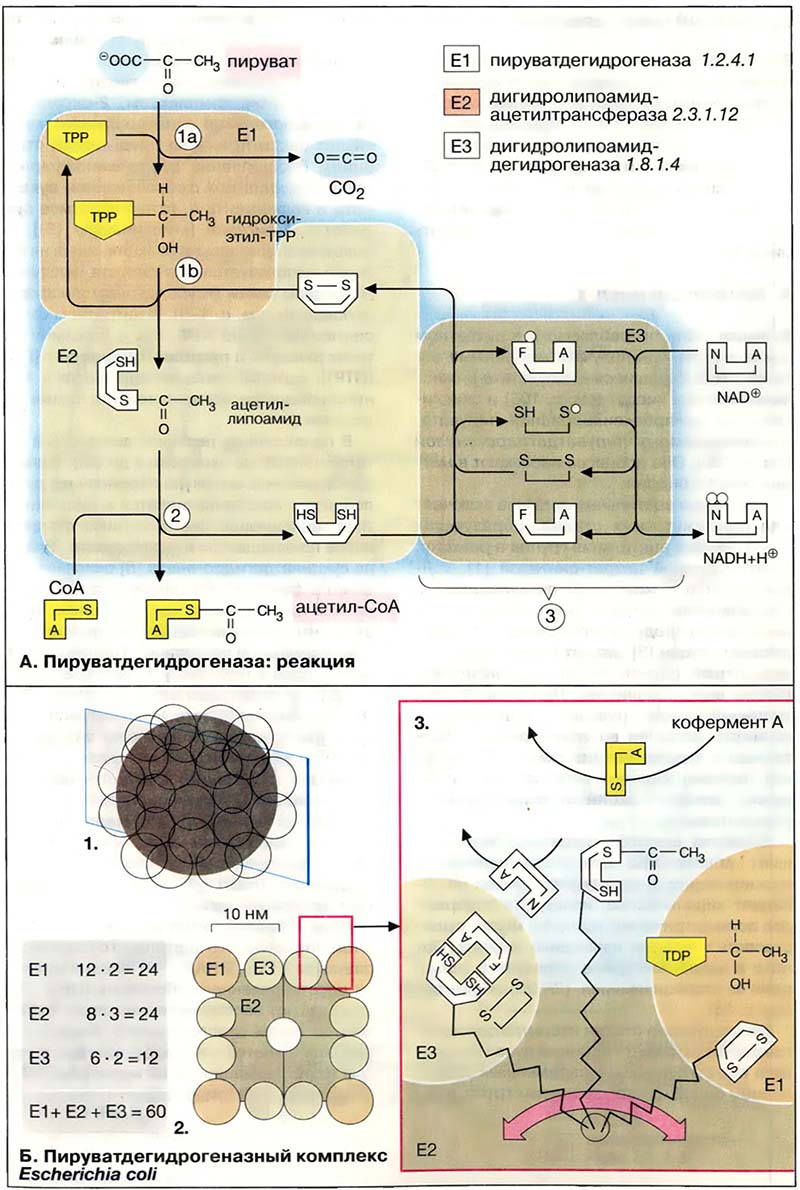
В пируватдегидрогеназной реакции участвуют три различных фермента [1-3]. Пируватдегидрогеназа (E1) катализирует декарбоксилирование пирувата, перенос образованного гидроксиэтильного остатка на тиаминдифосфат (ТРР, 1 а), а также окисление гидроксиэтильной группы с образованием ацетильного остатка. Этот остаток и полученные восстановительные эквиваленты переносятся на липоамид (16). Следующий фермент, дигидролипоамидацетилтрансфераза (E2) переносит ацетильный остаток с липоамида на кофермент A (2), при этом липоамид восстанавливается до дигидролипоамида. Последний снова окисляется до липоамида третьим ферментом, дигидролипоамиддегидрогеназой (E3) с образованием НАДН + Н+ (NADH + Н+) (3). Электроны переносятся на растворимый НАД+ через ФАД и каталитически активный дисульфидный мостик субъединицы E3.
Пять разных коферментов этой реакции различными способами ассоциированы с белковыми компонентами ферментов. Тиаминдифосфат нековалентно связан на Е1. Липоамид ковалентно связан с остатком лизина Е2, а ФАД прочно ассоциирован в виде простетической группы на E3. НАД+ (NAD+) и кофермент А взаимодействуют с комплексом в виде растворимых коферментов.
Пять разных коферментов этой реакции различными способами ассоциированы с белковыми компонентами ферментов. Тиаминдифосфат нековалентно связан на Е1. Липоамид ковалентно связан с остатком лизина Е2, а ФАД прочно ассоциирован в виде простетической группы на E3. НАД+ (NAD+) и кофермент А взаимодействуют с комплексом в виде растворимых коферментов.
Статьи раздела «Дегидрогеназы кетокислот»:
- Дегидрогеназы кетокислот
- А. Пируватдегидрогеназа: реакция
- Б. Пируватдегидрогеназный комплекс Escherichia coli
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Микрокосм. E. coli и новая наука о жизни
Микрокосм. E. coli и новая наука о жизни Цитата «В начале XX в. учёные, стремясь познать природу жизни, начали исследовать ...
В монографии рассматривается история развития учения об «антропотоксинах», ...
 Объекты биологии развития
Объекты биологии развития Монография представляет собой вторую книгу из серии «Проблемы биологии ...