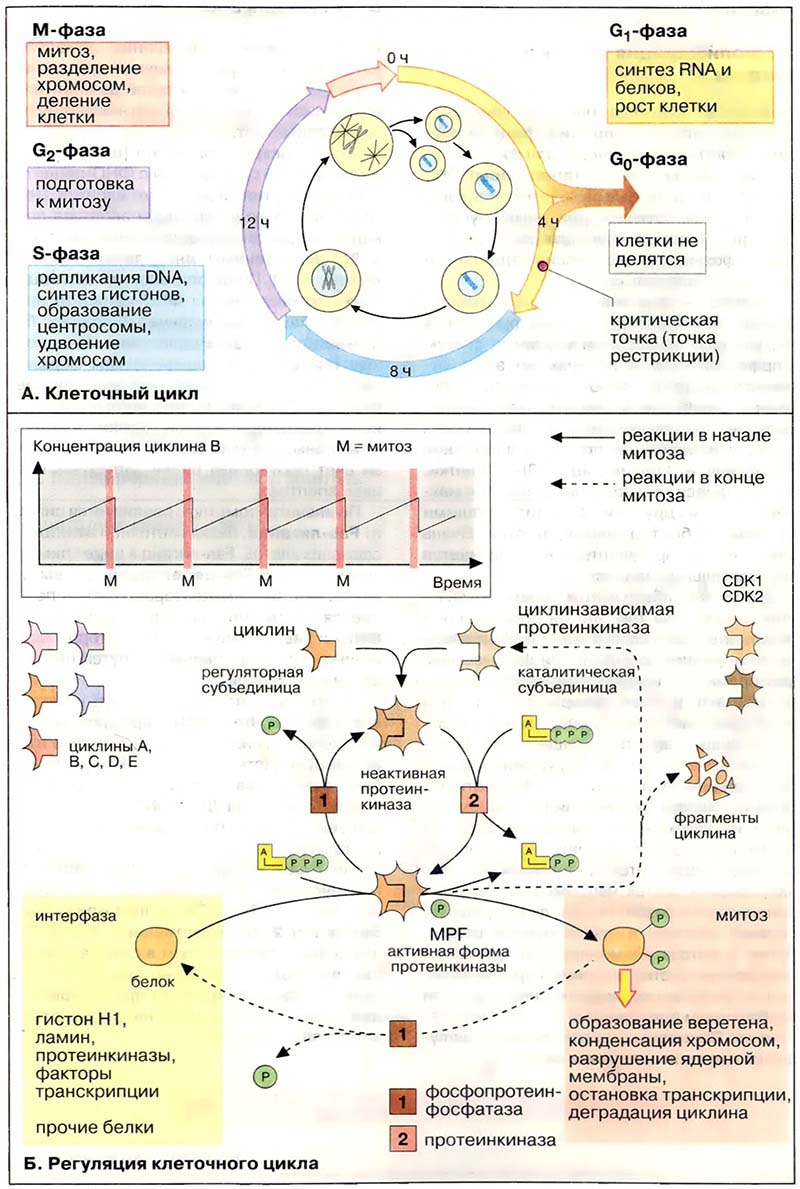
Регуляция клеточного цикла осуществляется посредством обратимого фосфорилирования/дефосфорилирования регуляторных белков (см. Транскрипция). Ключевым белком, регулирующим вступление клетки в митоз (G2/M-переход), является специфическая серин/треонин-протеинкиназа, которая носит название фактор созревания [ФС (MPF, от англ. maturation promoting factor)]. В активной форме фермент катализирует фосфорилирование многих белков, принимающих участие в митозе, таких, например, как входящий в состав хроматина гистон H1 (см. Геном), ламин (компонент цитоскелета, обнаруженный в ядерной мембране), факторы транскрипции, белки митотического веретена и ряд ферментов. Фосфорилирование этих белков запускает процесс митоза. После завершения митоза регуляторная субъединица ФС, циклин, маркируется убиквитином и подвергается протеолизу (см. Протеолиз). Теперь наступает очередь протеин-фосфатаз, которые дефосфорилируют белки, принимавшие участие в митозе, после чего клетка возвращается в состояние интерфазы.
ФС — гетеродимерный фермент, включающий регуляторную субъединицу, циклин, и каталитическую субъединицу, цикпинзави-симую киназу [ЦЗК (CDK от англ. cyclin dependent kinase) или p34cdc2; 34 кДа]. Активной формой фермента является лишь димер ЦЗК+циклин. Кроме того, активность протеинкиназы регулируется путём обратимого фосфорилирования самого фермента (на схеме представлен предельно простой вариант этого процесса).
В клетках позвоночных присутствует ряд различных циклинов и циклинзависимых киназ. Разнообразные сочетания двух субъединиц фермента регулируют запуск митоза, начало процесса транскрипции в G1-фазе, переход критической точки после завершения транскрипции, начало процесса репликации ДНК в S-периоде интерфазы (стартовый переход) и другие ключевые переходы клеточного цикла (на схеме не приведены).
В ооцитах лягушки вступление в митоз (G2/M-nepexoд) регулируется путём изменения концентрации циклина. Циклин непрерывно синтезируется в интерфазе до достижения максимальной концентрации в фазе М, когда запускается весь каскад фосфорилирования белков, катализируемый ФС. К окончанию митоза циклин быстро разрушается протеиназами, также активируемыми ФС. В других клеточных системах активность ФС регулируется за счёт различной степени фосфорилирования самого фермента.
ФС — гетеродимерный фермент, включающий регуляторную субъединицу, циклин, и каталитическую субъединицу, цикпинзави-симую киназу [ЦЗК (CDK от англ. cyclin dependent kinase) или p34cdc2; 34 кДа]. Активной формой фермента является лишь димер ЦЗК+циклин. Кроме того, активность протеинкиназы регулируется путём обратимого фосфорилирования самого фермента (на схеме представлен предельно простой вариант этого процесса).
В клетках позвоночных присутствует ряд различных циклинов и циклинзависимых киназ. Разнообразные сочетания двух субъединиц фермента регулируют запуск митоза, начало процесса транскрипции в G1-фазе, переход критической точки после завершения транскрипции, начало процесса репликации ДНК в S-периоде интерфазы (стартовый переход) и другие ключевые переходы клеточного цикла (на схеме не приведены).
В ооцитах лягушки вступление в митоз (G2/M-nepexoд) регулируется путём изменения концентрации циклина. Циклин непрерывно синтезируется в интерфазе до достижения максимальной концентрации в фазе М, когда запускается весь каскад фосфорилирования белков, катализируемый ФС. К окончанию митоза циклин быстро разрушается протеиназами, также активируемыми ФС. В других клеточных системах активность ФС регулируется за счёт различной степени фосфорилирования самого фермента.
Статьи раздела «Клеточный цикл»:
- А. Клеточный цикл
- Б. Регуляция клеточного цикла
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology
Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology Synthesizing over thirty years of advances into a comprehensive textbook, Biomolecular Crystallography describes the fundamentals, practices, and ...
Москва, 1955 год. Академия наук СССР. Издательский переплёт. Сохранность хорошая. На ...
 Biotechnology Annual R Volume 14 (Biotechnology Annual Review) (Biotechnology Annual Review)
Biotechnology Annual R Volume 14 (Biotechnology Annual Review) (Biotechnology Annual Review) Biotechnology is a diverse, complex, and rapidly evolving field. Students and experienced researchers alike face the challenges of staying on top of ...
В книге обобщён большой опыт, накопленный за последние годы в области применения ...