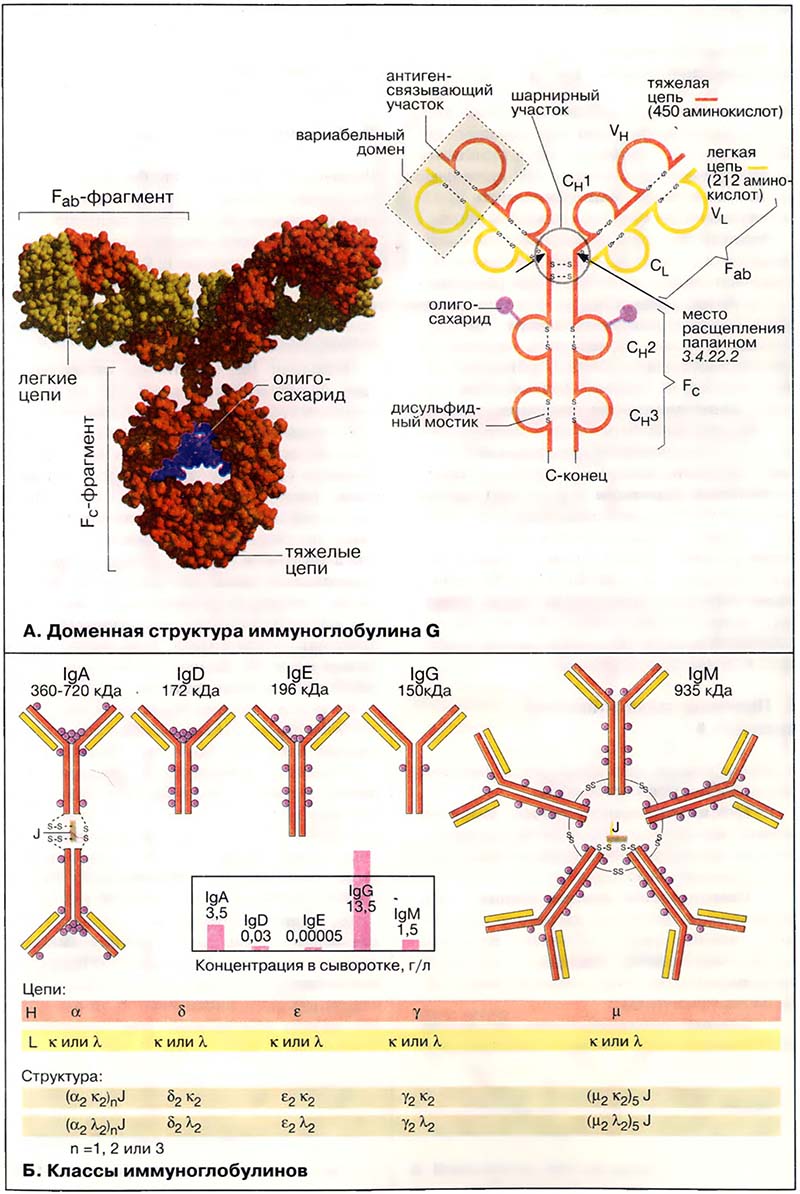
Иммуноглобулины (Ig), или антитела, являются семейством Y-образных (по пространственной структуре) гликопротеинов, у которых обе вершины («буквы Y») могут связывать антиген. Иммуноглобулины находятся в виде мембранных белков на поверхности лимфоцитов и в свободном виде в плазме крови. На схеме показана структура наиболее важного из них — иммуноглобулина класса G (IgG). Молекула представляет собой крупный тетрамер (H2L2 с 150 кДа) из двух идентичных тяжёлых цепей (Н-цепей, на схеме красного или оранжевого цвета) и двух идентичных лёгких цепей (L-цепей, на схеме жёлтого цвета). В обеих Н-цепях имеется ковалентно связанный олигосахарид (на схеме фиолетового цвета; см. также Окислительно-восстановительные коферменты).
Иммуноглобулины расщепляются протеиназой папаином на два Fab-фрагмента и один Fc-фрагмент. Оба Fab-фрагмента (от англ. antigen binding fragment — антиген-связывающий фрагмент) состоят соответственно из одной L-цепи и N-концевой части Н-цепи. Изолированные Fab-фрагменты сохраняют способность связывать антиген. Fc-Фрагмент (от англ. fragment crystallizable — способный кристаллизоваться) состоит из C-концевой половины обеих Н-цепей. Эта часть IgG выполняет функции связывания с клеточной поверхностью, взаимодействия с системой комплемента и участвует в переносе антител клетками.
Несмотря на большое разнообразие в иммуноглобулинах соблюдается общий принцип строения. Обе тяжёлые пептидные цепи (Н-цепи) IgG состоят из четырёх глобулярных доменов VH, Cн1, Cн2 и Сн3, обе лёгкие (L- цепи) — из двух глобулярных доменов CL и VL. При этом буквы C и V соответственно обозначают константные (англ. constant) и вариабельные (англ. variable) области. Обе тяжёлые цепи, а также тяжёлая цепь с лёгкой, связаны дисульфидными мостиками. Дисульфидные мостики внутри доменов стабилизируют третичную структуру. Домены имеют длину около 110 аминокислот и обладают взаимной гомологией (см. Белки главного комплекса гисто-совместимости). Такая структура антител, очевидно, возникла благодаря дубликации гена.
В центральной области молекул иммуноглобулинов расположен шарнирный участок, который придаёт антителам внутримолекулярную подвижность.
Иммуноглобулины расщепляются протеиназой папаином на два Fab-фрагмента и один Fc-фрагмент. Оба Fab-фрагмента (от англ. antigen binding fragment — антиген-связывающий фрагмент) состоят соответственно из одной L-цепи и N-концевой части Н-цепи. Изолированные Fab-фрагменты сохраняют способность связывать антиген. Fc-Фрагмент (от англ. fragment crystallizable — способный кристаллизоваться) состоит из C-концевой половины обеих Н-цепей. Эта часть IgG выполняет функции связывания с клеточной поверхностью, взаимодействия с системой комплемента и участвует в переносе антител клетками.
Несмотря на большое разнообразие в иммуноглобулинах соблюдается общий принцип строения. Обе тяжёлые пептидные цепи (Н-цепи) IgG состоят из четырёх глобулярных доменов VH, Cн1, Cн2 и Сн3, обе лёгкие (L- цепи) — из двух глобулярных доменов CL и VL. При этом буквы C и V соответственно обозначают константные (англ. constant) и вариабельные (англ. variable) области. Обе тяжёлые цепи, а также тяжёлая цепь с лёгкой, связаны дисульфидными мостиками. Дисульфидные мостики внутри доменов стабилизируют третичную структуру. Домены имеют длину около 110 аминокислот и обладают взаимной гомологией (см. Белки главного комплекса гисто-совместимости). Такая структура антител, очевидно, возникла благодаря дубликации гена.
В центральной области молекул иммуноглобулинов расположен шарнирный участок, который придаёт антителам внутримолекулярную подвижность.
Статьи раздела «Антитела»:
- А. Доменная структура иммуноглобулина G
- Б. Классы иммуноглобулинов
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Металлы, находящиеся в незначительных количествах внутри живого организма, ...
 Атлас. Морфология крахмала и крахмалопродуктов
Атлас. Морфология крахмала и крахмалопродуктов В атласе приведены данные о морфологической характеристике нативных крахмалов: ...
Книга посвящена ряду актуальных проблем молекулярной биологии (молекулярный ...
 Practical Forensic Microscopy: A Laboratory Manual
Practical Forensic Microscopy: A Laboratory Manual Forensic Microscopy: A Laboratory Manual will provide the student with a practical overview and understanding of the various microscopes and ...