ЛДГ катализирует передачу восстановительного эквивалента от лактата на НАД+ (NAD+) или от НАДН (NADH) на пируват.
L-лактат + НАД+ ↔ пируват + НАДН + Н+
Равновесие реакции сдвинуто в сторону образования лактата (см. Фосфолипиды и гликолипиды). Однако при высоких концентрациях лактата и НАД+ возможно окисление лактата в пируват. ЛДГ катализирует реакцию в обоих направлениях, но подобно всем ферментам не влияет на положение химического равновесия.
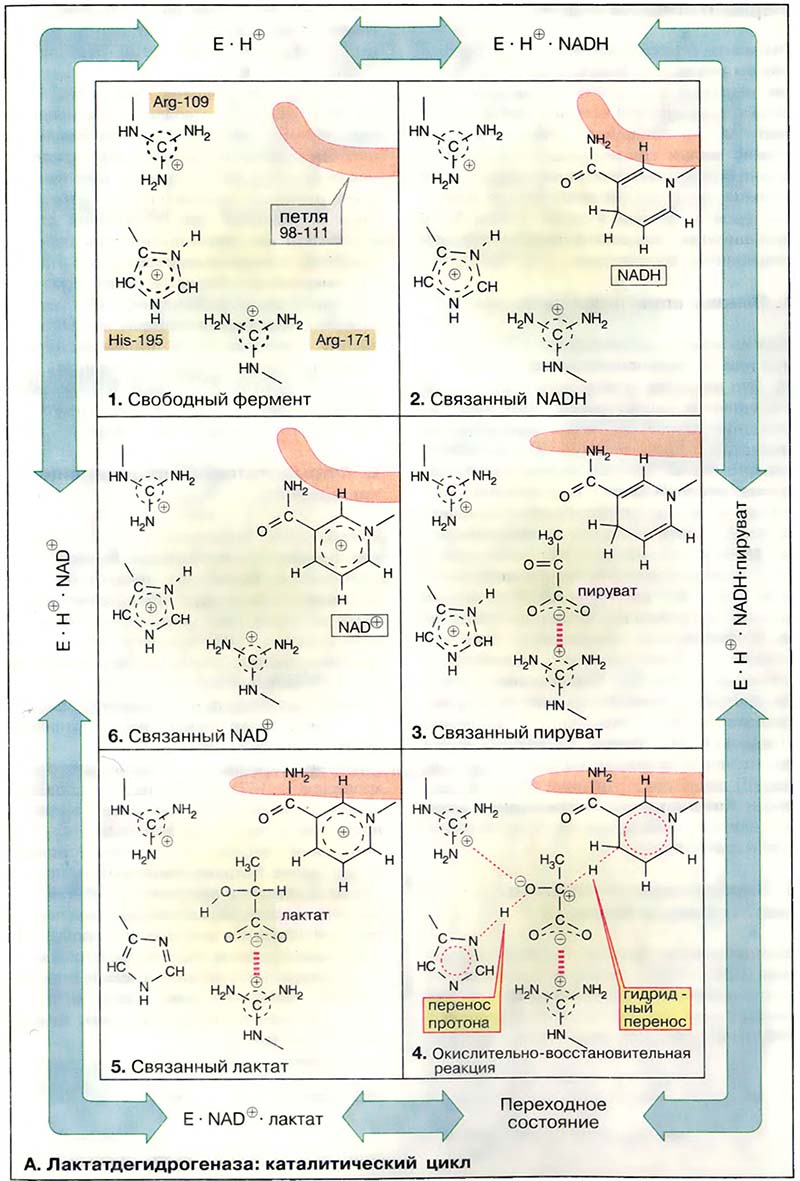
Из-за обратимости реакции каталитический процесс можно представить в виде движения по кругу. Каталитический цикл ЛДГ представлен на схеме в виде шести моментальных «снимков». Приведённые на схеме промежуточные стадии катализа очень кратковременны и поэтому строго не доказаны. Однако их существование подтверждается множеством экспериментальных данных.
В активном центре ЛДГ принимают участие многие аминокислотные остатки. Они способствуют присоединению субстратов и кофермента или непосредственно участвуют в одной из стадий катализа. Здесь показаны лишь три особенно важные боковые цепи аминокислот: положительно заряженная гуанидиновая группа аргинина-171 связывает карбоксильную группу субстрата с помощью электростатического взаимодействия, имидазольная группа гистидина-195 принимает участие в кислотно-основном катализе, боковая цепь аргинина-109 важна для стабилизации переходного состояния В противоположность His-195, меняющему свой заряд во время катализа, оба упомянутых остатка аргинина протонированы постоянно. Кроме этих трёх остатков важную роль играет пептидная петля 98-111, показанная схематически (окрашена в малиновый цвет) (см. Митохондрии: структура и функции). Её функция состоит в том, чтобы после связывания субстрата и кофермента закрыть активный центр и исключить доступ молекул воды во время переноса электронов.
Рассмотрим теперь отдельные стадии катализируемого ЛДГ восстановления пирувата: в свободном ферменте (1) His-195 протонирован, в связи с чем эта форма обозначена как Е×Н+. Кофермент НАДН связывается первым (2), а за ним — пируват (3). Важно, что в молекуле фермента карбонильная группа пирувата и никотинамидное кольцо кофермента в активированном состоянии расположены друг относительно друга оптимально и такая ориентация фиксирована (сближение и ориентирование субстратов). Затем закрывается петля 98-111 над активным центром. Сильно пониженная полярность в области активного центра облегчает образование переходного состояния (4; доступ воды закрыт). В переходном состоянии гидрид-ион Н′′ (см. Лактатдегидрогеназа: механизм каталитической реакции) переносится с кофермента на карбонильный углерод (перенос группы). При этом временно образующийся энергетически невыгодный отрицательный заряд на кислороде стабилизируется электростатическим взаимодействием с Arg-109 (стабилизация переходного состояния). Одновременно осуществляется перенос протона с His-195 на атом кислорода (перенос группы), приводя к образованию связанных с ферментом лактата и НАД+ (5). После открытия петли лактат диссоциирует с фермента и временно незаряженная имидазольная группа His-195 снова присоединяет протон из окружающей воды (6). Наконец, освобождается также окисленный кофермент НАД+ и снова достигается исходное состояние (1). При окислении лактата в пируват протекают те же стадии, но в противоположном направлении.
Входящий в уравнение реакции протон присоединяется не одновременно с NADH, а после освобождения лактата, то есть между стадиями (5) и (6) предшествующего цикла.
L-лактат + НАД+ ↔ пируват + НАДН + Н+
Равновесие реакции сдвинуто в сторону образования лактата (см. Фосфолипиды и гликолипиды). Однако при высоких концентрациях лактата и НАД+ возможно окисление лактата в пируват. ЛДГ катализирует реакцию в обоих направлениях, но подобно всем ферментам не влияет на положение химического равновесия.
Из-за обратимости реакции каталитический процесс можно представить в виде движения по кругу. Каталитический цикл ЛДГ представлен на схеме в виде шести моментальных «снимков». Приведённые на схеме промежуточные стадии катализа очень кратковременны и поэтому строго не доказаны. Однако их существование подтверждается множеством экспериментальных данных.
В активном центре ЛДГ принимают участие многие аминокислотные остатки. Они способствуют присоединению субстратов и кофермента или непосредственно участвуют в одной из стадий катализа. Здесь показаны лишь три особенно важные боковые цепи аминокислот: положительно заряженная гуанидиновая группа аргинина-171 связывает карбоксильную группу субстрата с помощью электростатического взаимодействия, имидазольная группа гистидина-195 принимает участие в кислотно-основном катализе, боковая цепь аргинина-109 важна для стабилизации переходного состояния В противоположность His-195, меняющему свой заряд во время катализа, оба упомянутых остатка аргинина протонированы постоянно. Кроме этих трёх остатков важную роль играет пептидная петля 98-111, показанная схематически (окрашена в малиновый цвет) (см. Митохондрии: структура и функции). Её функция состоит в том, чтобы после связывания субстрата и кофермента закрыть активный центр и исключить доступ молекул воды во время переноса электронов.
Рассмотрим теперь отдельные стадии катализируемого ЛДГ восстановления пирувата: в свободном ферменте (1) His-195 протонирован, в связи с чем эта форма обозначена как Е×Н+. Кофермент НАДН связывается первым (2), а за ним — пируват (3). Важно, что в молекуле фермента карбонильная группа пирувата и никотинамидное кольцо кофермента в активированном состоянии расположены друг относительно друга оптимально и такая ориентация фиксирована (сближение и ориентирование субстратов). Затем закрывается петля 98-111 над активным центром. Сильно пониженная полярность в области активного центра облегчает образование переходного состояния (4; доступ воды закрыт). В переходном состоянии гидрид-ион Н′′ (см. Лактатдегидрогеназа: механизм каталитической реакции) переносится с кофермента на карбонильный углерод (перенос группы). При этом временно образующийся энергетически невыгодный отрицательный заряд на кислороде стабилизируется электростатическим взаимодействием с Arg-109 (стабилизация переходного состояния). Одновременно осуществляется перенос протона с His-195 на атом кислорода (перенос группы), приводя к образованию связанных с ферментом лактата и НАД+ (5). После открытия петли лактат диссоциирует с фермента и временно незаряженная имидазольная группа His-195 снова присоединяет протон из окружающей воды (6). Наконец, освобождается также окисленный кофермент НАД+ и снова достигается исходное состояние (1). При окислении лактата в пируват протекают те же стадии, но в противоположном направлении.
Входящий в уравнение реакции протон присоединяется не одновременно с NADH, а после освобождения лактата, то есть между стадиями (5) и (6) предшествующего цикла.
Статьи раздела «Лактатдегидрогеназа: механизм каталитической реакции»:
- Лактатдегидрогеназа: механизм каталитической реакции
- А. Лактатдегидрогеназа: каталитический цикл
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Introductory Chemistry: Concepts and Critical Thinking (6th Edition)
Introductory Chemistry: Concepts and Critical Thinking (6th Edition) Introductory Chemistry: Concepts and Critical Thinking, Sixth Edition is a comprehensive learning system that offers print and media resources as well ...
 Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation
Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation A novel role of TCF family in body axis formation. Revolutionary high impact discoveries are described, elucidating the missing link in the Wnt ...
 Современные успехи химии и биологии моря
Современные успехи химии и биологии моря Книга Харвея, содержащая много фактического материала и интересных выводов, ...
