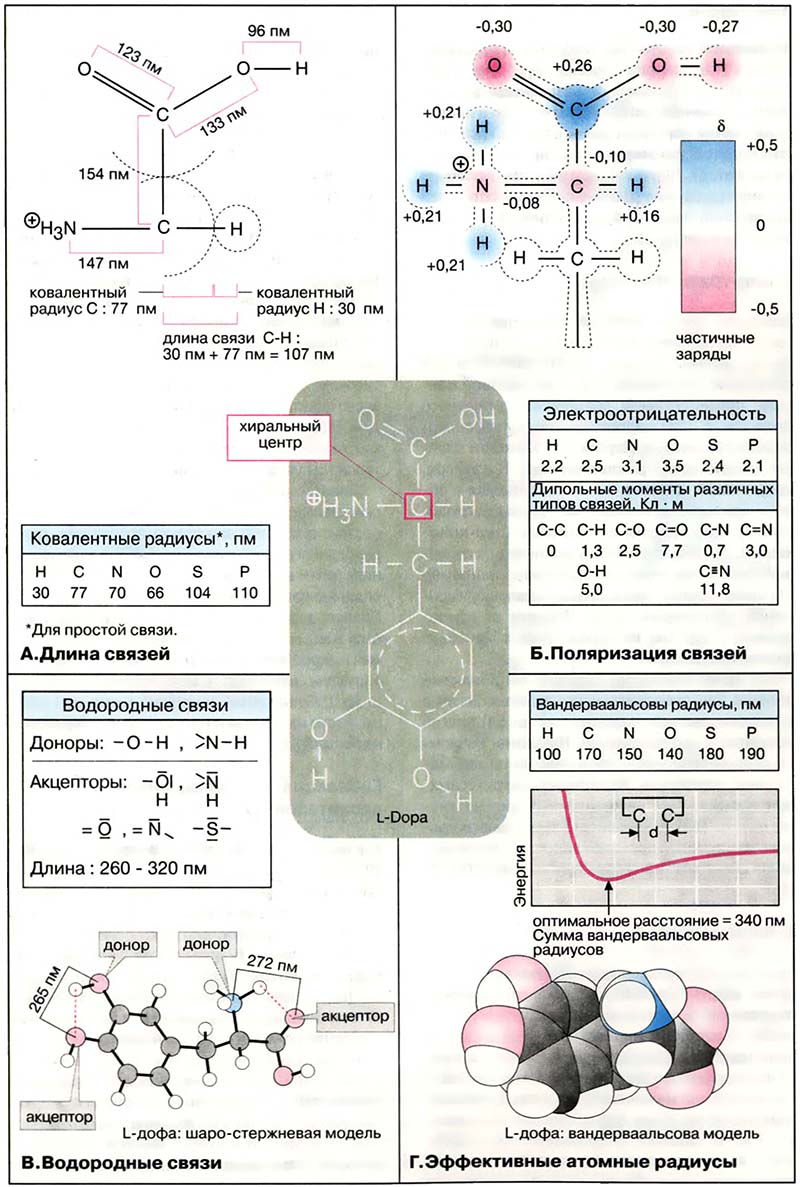
Особый тип нековалентной связи — водородная связь — имеет в биохимии исключительно важное значение. В образовании водородной связи принимают участие атомы водорода OH-, NH- и SH-групп (так называемых доноров водородной связи), которые взаимодействуют со свободной парой электронов атомов-акцепторов (например, O, N или S). Энергия водородной связи составляет 10-40 кДж/моль, что значительно меньше энергии ковалентной связи (меньше 400 кДж/моль). Однако многочисленные водородные связи вносят существенный вклад в стабилизацию структуры многих макромолекул (см. Глюконеогенез, Дезоксирибонуклеиновые кислоты). Например, L-дофа может образовывать две внутримолекулярные водородные связи. На шаро-стержневой модели L-дофа водородные мостики указаны штрихами.
Статьи раздела «Строение молекул»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Клеточные механизмы токсичности аммиака
Клеточные механизмы токсичности аммиака В настоящей книге авторы попытались кратко изложить исторически сложившиеся и ...
 Лекции по природоведческой микробиологии
Лекции по природоведческой микробиологии Книга основана на курсе лекций, прочитанных в МГУ им. М. В. Ломоносова в 1995-2002 гг. ...
 Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition)
Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition) The Third Edition of Microbiology with Diseases by Taxonomy is the most cutting-edge microbiology book available, offering unparalleled currency, ...
 Biological Aging: Methods and Protocols
Biological Aging: Methods and Protocols Biological Aging: Methods and Protocols investigates the various processes that are affected by the age of an organism. Several new tools for the ...