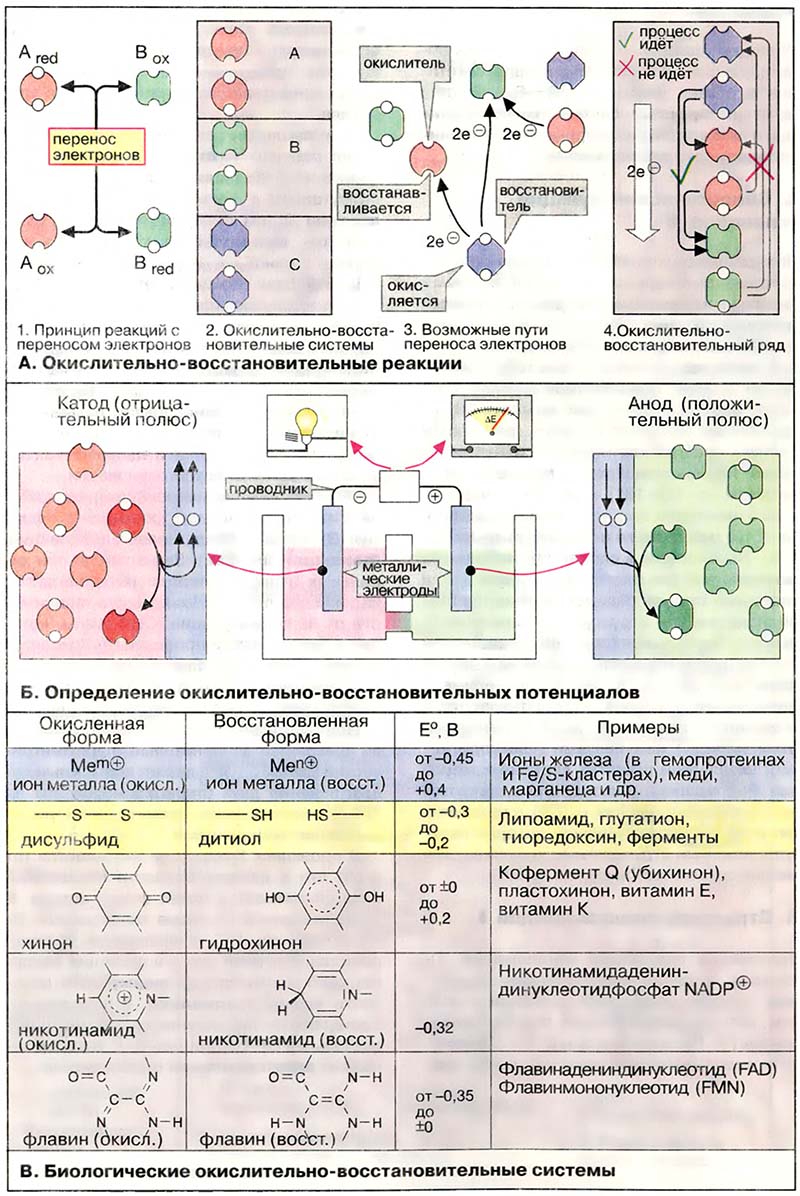
Положение редокс-пары в ряду определяется окислительно-восстановительным потенциалом. Последний определяют (см. Равновесие) с помощью электрохимической ячейки, которая позволяет оценивать перенос электронов между двумя редокс-парами, находящимися в разных сосудах. Прохождение электрического тока в результате переноса электронов между двумя химическими частицами, находящимися в разных сосудах, осуществляется через проводник, то есть химическая энергия трансформируется в электрическую.
В цепь встроен высокоомный вольтметр, исключающий прохождение электрического тока. Измеряют не ток, а электрическое напряжение, которое соответствует разности электрического потенциала ΔE двух растворов. Восстановительный потенциал системы определяется как э.д.с. в вольтах (В), измеренная против известного потенциала, возникающего в стандартном полуэлементе (полуячейке). В качестве стандарта принят восстановительный потенциал системы 2H+/H2 («водородный электрод»), который при определённых условиях условно считают равным нулю. Измеренный относительно стандарта потенциал конкретной окислительно-восстановительной пары может иметь знак плюс или знак минус. Величина Е зависит от концентрации реагентов и условий проведения реакции. Поэтому вводят понятие стандартный окислительно-восстановительный потенциал (или восстановительный потенциал Е°, поскольку он характеризует реакцию восстановления), который определяют как потенциал восстановления данной редокс-пары в стандартных условиях и при равных концентрациях всех реагентов, а также Е°’, определяемый как Е° при pH 7. Если пары расположить в порядке возрастания их восстановительных потенциалов, то получим электрохимический ряд напряжений (4). Спонтанный перенос электрона возможен лишь в том случае, если восстановительный потенциал вещества, которое должно отдавать электроны, — величина более отрицательная по сравнению с потенциалом вещества, которое должно принимать электроны.
В цепь встроен высокоомный вольтметр, исключающий прохождение электрического тока. Измеряют не ток, а электрическое напряжение, которое соответствует разности электрического потенциала ΔE двух растворов. Восстановительный потенциал системы определяется как э.д.с. в вольтах (В), измеренная против известного потенциала, возникающего в стандартном полуэлементе (полуячейке). В качестве стандарта принят восстановительный потенциал системы 2H+/H2 («водородный электрод»), который при определённых условиях условно считают равным нулю. Измеренный относительно стандарта потенциал конкретной окислительно-восстановительной пары может иметь знак плюс или знак минус. Величина Е зависит от концентрации реагентов и условий проведения реакции. Поэтому вводят понятие стандартный окислительно-восстановительный потенциал (или восстановительный потенциал Е°, поскольку он характеризует реакцию восстановления), который определяют как потенциал восстановления данной редокс-пары в стандартных условиях и при равных концентрациях всех реагентов, а также Е°’, определяемый как Е° при pH 7. Если пары расположить в порядке возрастания их восстановительных потенциалов, то получим электрохимический ряд напряжений (4). Спонтанный перенос электрона возможен лишь в том случае, если восстановительный потенциал вещества, которое должно отдавать электроны, — величина более отрицательная по сравнению с потенциалом вещества, которое должно принимать электроны.
Статьи раздела «Окислительно-восстановительные процессы»:
- А. Окислительно-восстановительные реакции
- Б. Определение окислительно-восстановительных потенциалов
- В. Биологические окислительно-восстановительные пары
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Впервые в русскоязычной литературе системно изложены и даны толкования более 1 600 ...
 Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition)
Microbiology with Diseases by Taxonomy with MasteringMicrobiology (3rd Edition) The Third Edition of Microbiology with Diseases by Taxonomy is the most cutting-edge microbiology book available, offering unparalleled currency, ...
