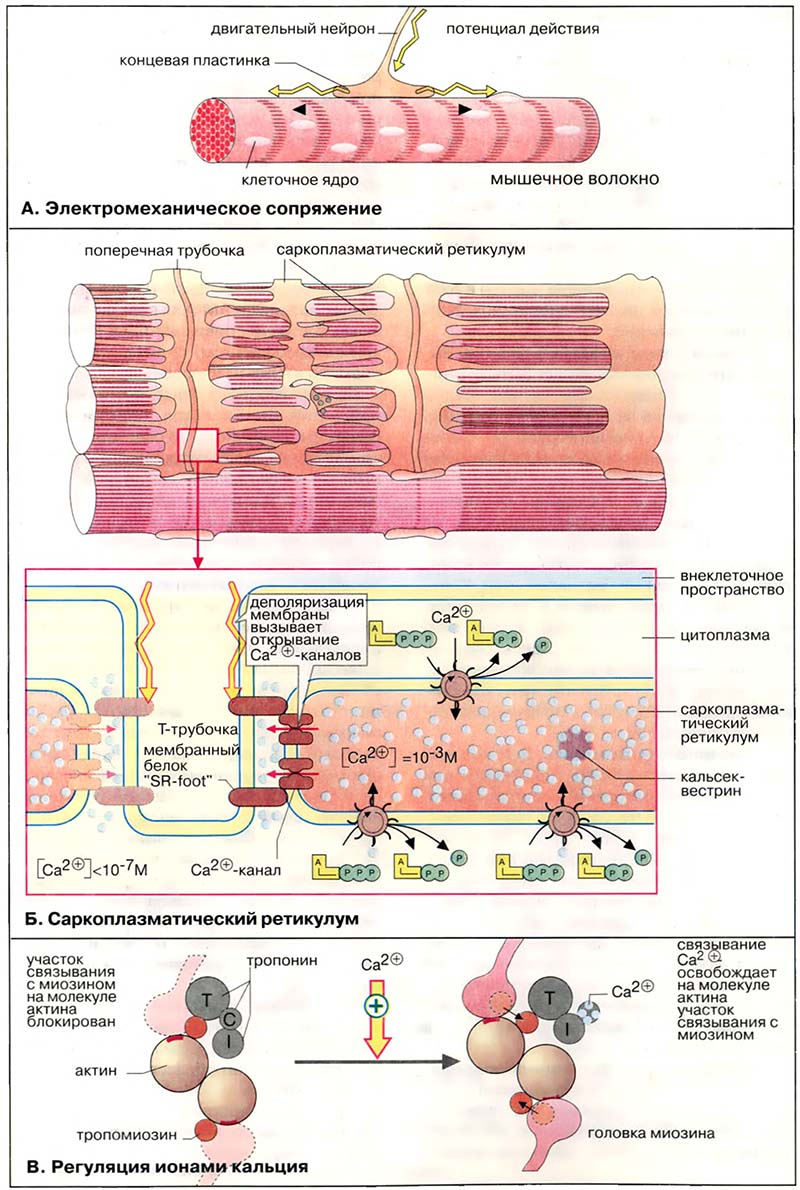
В расслабленной скелетной мышце комплекс тропонина (субъединицы = Т, C, I) с тропомиозином препятствует взаимодействию миозиновых головок с актином. Быстрое увеличение в цитоплазме концентрации ионов кальция в результате открывания каналов СР приводит к связыванию Ca2+ с C-субъединицей тропонина. Последняя по свойствам близка кальмодулину (см. Вторичные мессенджеры). Связывание ионов Ca2+ вызывает конформационную перестройку в тропонине, тропонинтропомиозиновый комплекс разрушается и освобождает на молекуле актина участок связывания с миозином (на схеме выделен красным цветом). Это инициирует цикл мышечного сокращения (см. Сократительная система)
В отсутствие последующего стимулирования АТФ-зависимые кальциевые насосы мембраны СР быстро снижают концентрацию ионов Са2+ до исходного уровня. Как следствие, комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, место связывания миозина на актине блокируется и мышца расслабляется.
Таким образом, при сокращении мышечного волокна скелетных мышц позвоночных происходит следующая последовательность событий. При поступлении сигнала от двигательного нейрона мембрана мышечной клетки деполяризуется, сигнал передаётся на Са2+-каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает. Ионы Са2+ связывается с тропонином C, вызывая конформационную перестройку в тропонине, что влечёт за собой разрушение комплекса тропонин-тропомиозин и даёт возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.
По завершении сокращения уровень ионов Са2+ снижается за счёт активного обратного транспорта Са2+ в СР, тропонин C отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекуле актина, блокируя актин-миозиновый цикл. Результатом является расслабление мышцы.
В отсутствие последующего стимулирования АТФ-зависимые кальциевые насосы мембраны СР быстро снижают концентрацию ионов Са2+ до исходного уровня. Как следствие, комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, место связывания миозина на актине блокируется и мышца расслабляется.
Таким образом, при сокращении мышечного волокна скелетных мышц позвоночных происходит следующая последовательность событий. При поступлении сигнала от двигательного нейрона мембрана мышечной клетки деполяризуется, сигнал передаётся на Са2+-каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает. Ионы Са2+ связывается с тропонином C, вызывая конформационную перестройку в тропонине, что влечёт за собой разрушение комплекса тропонин-тропомиозин и даёт возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.
По завершении сокращения уровень ионов Са2+ снижается за счёт активного обратного транспорта Са2+ в СР, тропонин C отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекуле актина, блокируя актин-миозиновый цикл. Результатом является расслабление мышцы.
Статьи раздела «Регуляция сокращения мышечных волокон»:
- А. Электромеханическое сопряжение
- Б. Саркоплазматический ретикулум
- В. Регуляция ионами кальция
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Молекулярная биология процессов развития
Молекулярная биология процессов развития Книга представляет собой полную сводку современных знаний о молекулярных ...
 Молекулярные механизмы взаимодействия эндотоксинов с клетками-мишенями
Молекулярные механизмы взаимодействия эндотоксинов с клетками-мишенями Открытие истинных рецепторов к эндотоксинам (липополисахаридам), сделанное на ...
 Handbook of Nanoindentation: With Biological Applications
Handbook of Nanoindentation: With Biological Applications Broadly divided into two parts, this guide’s first part presents the a’basic sciencea’ of nanoindentation, including the background of contact ...
