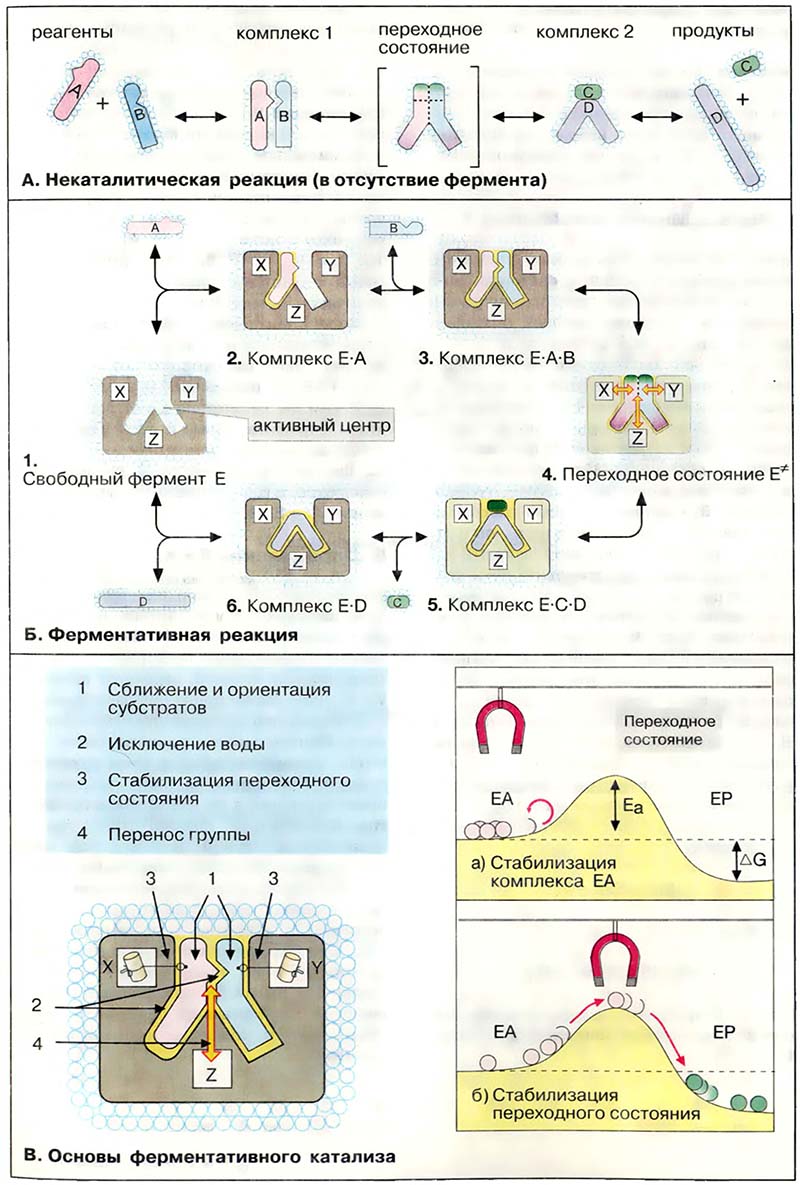
Несмотря на то, что сегодня трудно количественно оценить вклад отдельных каталитических эффектов, решающим фактором считается стабилизация переходного состояния в активном центре фермента. При этом наиболее существенным моментом является прочное связывание не столько субстрата, сколько его переходного состояния. Данное положение подтверждается крайне высоким сродством многих ферментов по отношению к аналогам переходного состояния (см. Ингибиторы), что можно пояснить простой механической аналогией (на схеме справа): если хотят перекатить металлические шарики (реагенты) с места ЕА (состояние субстрата) в энергетически более высокое переходное состояние, а затем в EP (состояние продукта), нужно расположить магнит (катализатор) таким образом, чтобы сила притяжения действовала не на ЕА (а), а на переходное состояние (б).
Статьи раздела «Ферментативный катализ»:
- Ферментативный катализ
- А. Некаталитическая реакция (в отсутствие фермента)
- Б. Ферментативная реакция
- В. Основы ферментативного катализа
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Планета вирусов
Планета вирусов Вирусы — невидимые, но активные участники борьбы за место в биосфере Земли. С их ...
В монографии рассматривается история развития учения об «антропотоксинах», ...
 Химия билирубина и его аналогов
Химия билирубина и его аналогов В настоящей монографии изложены результаты фундаментальных и прикладных ...
