Несмотря на то, что сегодня трудно количественно оценить вклад отдельных каталитических эффектов, решающим фактором считается стабилизация переходного состояния в активном центре фермента. При этом наиболее существенным моментом является прочное связывание не столько субстрата, сколько его переходного состояния. Данное положение подтверждается крайне высоким сродством многих ферментов по отношению к аналогам переходного состояния (см. Ингибиторы), что можно пояснить простой механической аналогией (на схеме справа): если хотят перекатить металлические шарики (реагенты) с места ЕА (состояние субстрата) в энергетически более высокое переходное состояние, а затем в EP (состояние продукта), нужно расположить магнит (катализатор) таким образом, чтобы сила притяжения действовала не на ЕА (а), а на переходное состояние (б).
Статьи раздела «Ферментативный катализ»:
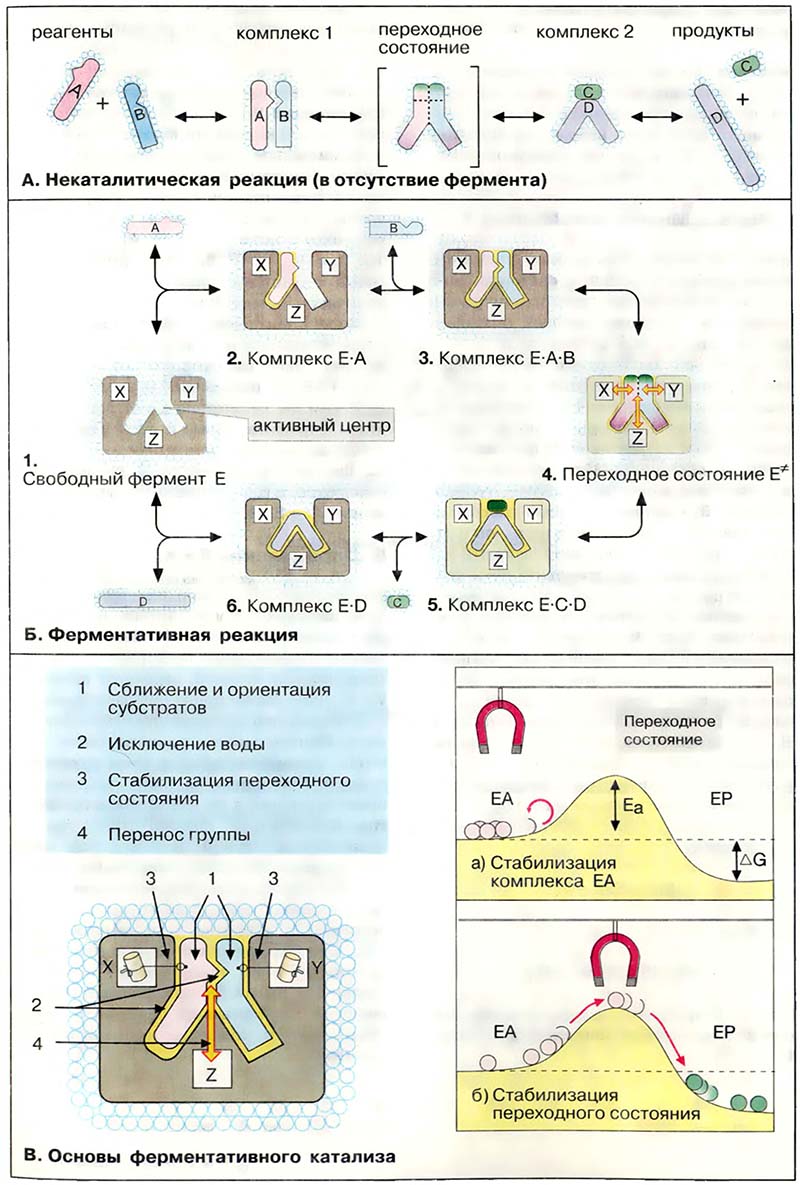
- Ферментативный катализ
- А. Некаталитическая реакция (в отсутствие фермента)
- Б. Ферментативная реакция
- В. Основы ферментативного катализа
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Введение в молекулярную биологию
Введение в молекулярную биологию Задача предлагаемой книги состоит в ознакомлении читателей с важнейшими фактами ...
Монография посвящена математическому моделированию и исследованию нелинейных ...
 Объекты биологии развития
Объекты биологии развития Монография представляет собой вторую книгу из серии «Проблемы биологии ...
 Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries)
Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries) During the upgrading of heavy petroleum, asphaltene is the most problematic impurity since it is the main cause of catalyst deactivation and sediments ...