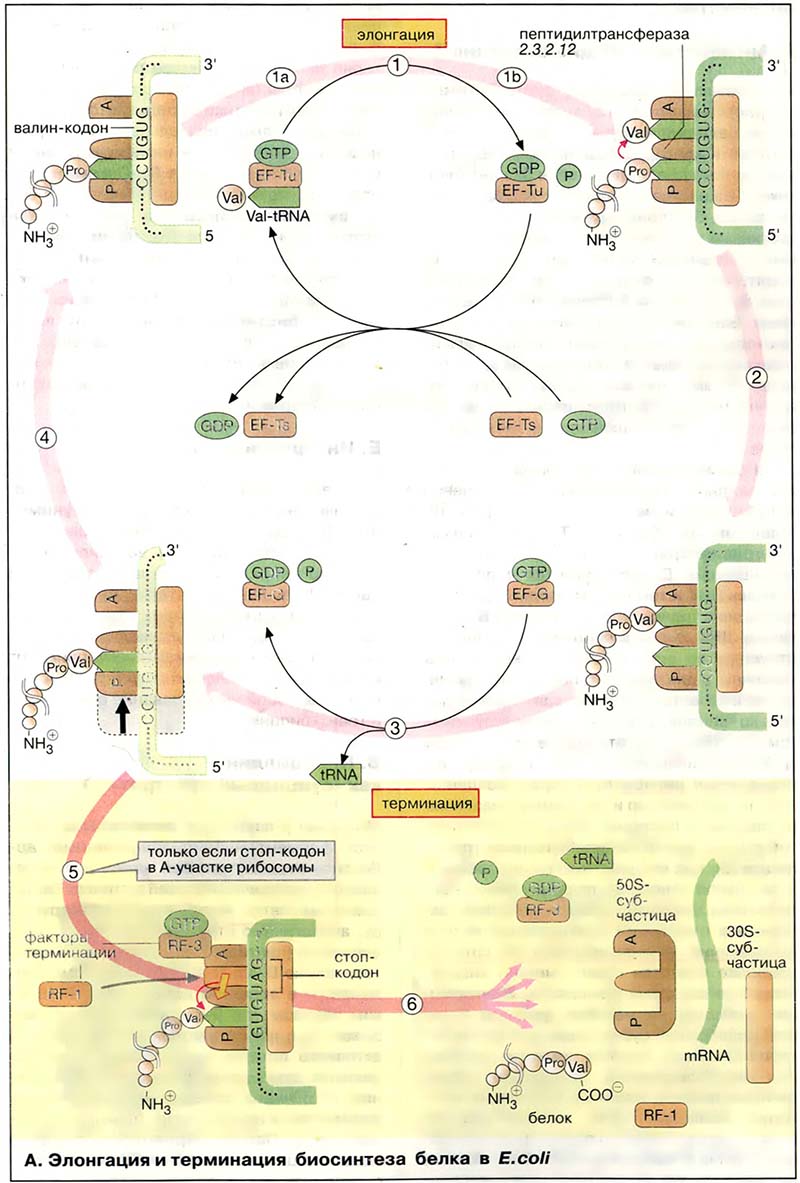
Элонгацию можно разделить на три стадии. В первой пептидильный участок (Р) рибосомы занимает тРНК (tRNA), несущая на 3′-конце растущую пептидную цепь (на схеме вверху слева). Затем вторая тРНК, соединённая с соответствующей аминокислотой (на рисунке показана Val-TPHKVal), взаимодействует своим антикодоном (см. Цикл мочевины) с кодоном мРНК, фиксированным на акцепторном участке (A, в данном случае GUG).
тРНК связывается в виде комплекса с ГТФ-содержащим белком, фактором элонгации Tu (EF-Tu) (1а). Диссоциация комплекса происходит только после того, как связанный ГТФ (GTP) гидролизуется до ГДФ (GDF) и фосфата (16). До гидролиза ГТФ взаимодействие тРНК с мРНК (mRNA) относительно слабое. Таким образом, гидролиз ГТФ с участием комплекса служит лимитирующим фактором, дающим время для проверки, правильно ли связана тРНК. Затем следующий белок, фактор элонгации Ts (EF-Ts), катализирует обмен ГДФ на ГТФ и таким образом регенерирует комплекс EF-Tu×GTP.
Собственно синтез пептидной связи происходит на следующей стадии (2). Рибосомная «пептидилтрансфераза» катализирует (без потребления АТФ) перенос растущей пептидной цепи от тРНК, находящейся в Р-участке, на аминогруппу валинового остатка, присоединённого к TPHKVal, связанной на A-участке. Пептидилтрансферазная активность рибосом зависит не от какого-либо рибосомного белка, а, скорее всего, связана с 28S-PHK. Каталитически активные РНК получили название рибозимов (см. Созревание РНК). Предполагают, что существующие рибозимы можно рассматривать как реликты «мира РНК» раннего периода биохимической эволюции, когда белки ещё не получили такого распространения и не приобрели такого значения, как в последующие периоды.
После переноса растущей цепи в A-участок, свободная аминоацил-тРНК диссоциирует от Р-участка (3) и с рибосомой связывается другой ГТФ-содержащий фактор элонгации (EF-G×GTP). Гидролиз ГТФ этим фактором даёт энергию для транслокации рибосомы (3). Во время этого процесса рибосома сдвигает мРНК на три основания в направлении 3′-конца. Поскольку тРНК, несущая полипептидную цепь, не меняет положения относительно мРНК, она попадает в P-участок рибосомы, в то время как следующий кодон мРНК (в данном случае GUG), попадает в A-участок. Теперь рибосома готова для вступления в следующий цикл элонгации (4).
Когда один из стоп-кодонов (UAG, UAA или UGA) попадает в A-участок, наступает терминация трансляции (5). Для стоп-кодонов нет соответствующих тРНК. Вместо этого с рибосомой связываются два белковых, высвобождающих фактора (англ. relising factor, RF). Один из них, RF-1, катализирует гидролитическое расщепление эфирной связи между тРНК и C-концом пептида, тем самым высвобождая белок. Энергию для диссоциации комплекса на составляющие компоненты поставляет ГТФ-содержащий фактор RF-3 (6).
Синтез белка требует высоких энергетических затрат. При присоединении одной аминокислоты к растущему полипептиду гидролизуется четыре макроэргические связи. Две молекулы АТФ гидролизуются при активации аминокислоты (см. Репликация, АТФ → АМФ + неорганический фосфат), и две молекулы ГТФ расходуются во время элогации. Кроме того, при инициации и терминации на каждую молекулу белка расходуется по одной молекуле ГТФ.
тРНК связывается в виде комплекса с ГТФ-содержащим белком, фактором элонгации Tu (EF-Tu) (1а). Диссоциация комплекса происходит только после того, как связанный ГТФ (GTP) гидролизуется до ГДФ (GDF) и фосфата (16). До гидролиза ГТФ взаимодействие тРНК с мРНК (mRNA) относительно слабое. Таким образом, гидролиз ГТФ с участием комплекса служит лимитирующим фактором, дающим время для проверки, правильно ли связана тРНК. Затем следующий белок, фактор элонгации Ts (EF-Ts), катализирует обмен ГДФ на ГТФ и таким образом регенерирует комплекс EF-Tu×GTP.
Собственно синтез пептидной связи происходит на следующей стадии (2). Рибосомная «пептидилтрансфераза» катализирует (без потребления АТФ) перенос растущей пептидной цепи от тРНК, находящейся в Р-участке, на аминогруппу валинового остатка, присоединённого к TPHKVal, связанной на A-участке. Пептидилтрансферазная активность рибосом зависит не от какого-либо рибосомного белка, а, скорее всего, связана с 28S-PHK. Каталитически активные РНК получили название рибозимов (см. Созревание РНК). Предполагают, что существующие рибозимы можно рассматривать как реликты «мира РНК» раннего периода биохимической эволюции, когда белки ещё не получили такого распространения и не приобрели такого значения, как в последующие периоды.
После переноса растущей цепи в A-участок, свободная аминоацил-тРНК диссоциирует от Р-участка (3) и с рибосомой связывается другой ГТФ-содержащий фактор элонгации (EF-G×GTP). Гидролиз ГТФ этим фактором даёт энергию для транслокации рибосомы (3). Во время этого процесса рибосома сдвигает мРНК на три основания в направлении 3′-конца. Поскольку тРНК, несущая полипептидную цепь, не меняет положения относительно мРНК, она попадает в P-участок рибосомы, в то время как следующий кодон мРНК (в данном случае GUG), попадает в A-участок. Теперь рибосома готова для вступления в следующий цикл элонгации (4).
Когда один из стоп-кодонов (UAG, UAA или UGA) попадает в A-участок, наступает терминация трансляции (5). Для стоп-кодонов нет соответствующих тРНК. Вместо этого с рибосомой связываются два белковых, высвобождающих фактора (англ. relising factor, RF). Один из них, RF-1, катализирует гидролитическое расщепление эфирной связи между тРНК и C-концом пептида, тем самым высвобождая белок. Энергию для диссоциации комплекса на составляющие компоненты поставляет ГТФ-содержащий фактор RF-3 (6).
Синтез белка требует высоких энергетических затрат. При присоединении одной аминокислоты к растущему полипептиду гидролизуется четыре макроэргические связи. Две молекулы АТФ гидролизуются при активации аминокислоты (см. Репликация, АТФ → АМФ + неорганический фосфат), и две молекулы ГТФ расходуются во время элогации. Кроме того, при инициации и терминации на каждую молекулу белка расходуется по одной молекуле ГТФ.
Статьи раздела «Рибосомы: элонгация, терминация»:
- Рибосомы: элонгация, терминация
- А. Элонгация и терминация биосинтеза белка в E.coli
- Дополнительная информация
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors
Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors Protein glycation, induced by hyperglycemia, is implicated in the appearance of diabetic complications and the aging process. Glycation involves the ...
 Fundamentals of Forensic DNA Typing
Fundamentals of Forensic DNA Typing An introductory text on forensic DNA analysis, written by the foremost expert in the field.
 Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries)
Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries) During the upgrading of heavy petroleum, asphaltene is the most problematic impurity since it is the main cause of catalyst deactivation and sediments ...
 Паразитические нематоды растений и насекомых
Паразитические нематоды растений и насекомых В книге представлены обобщающие работы по современным теоретическим и ...