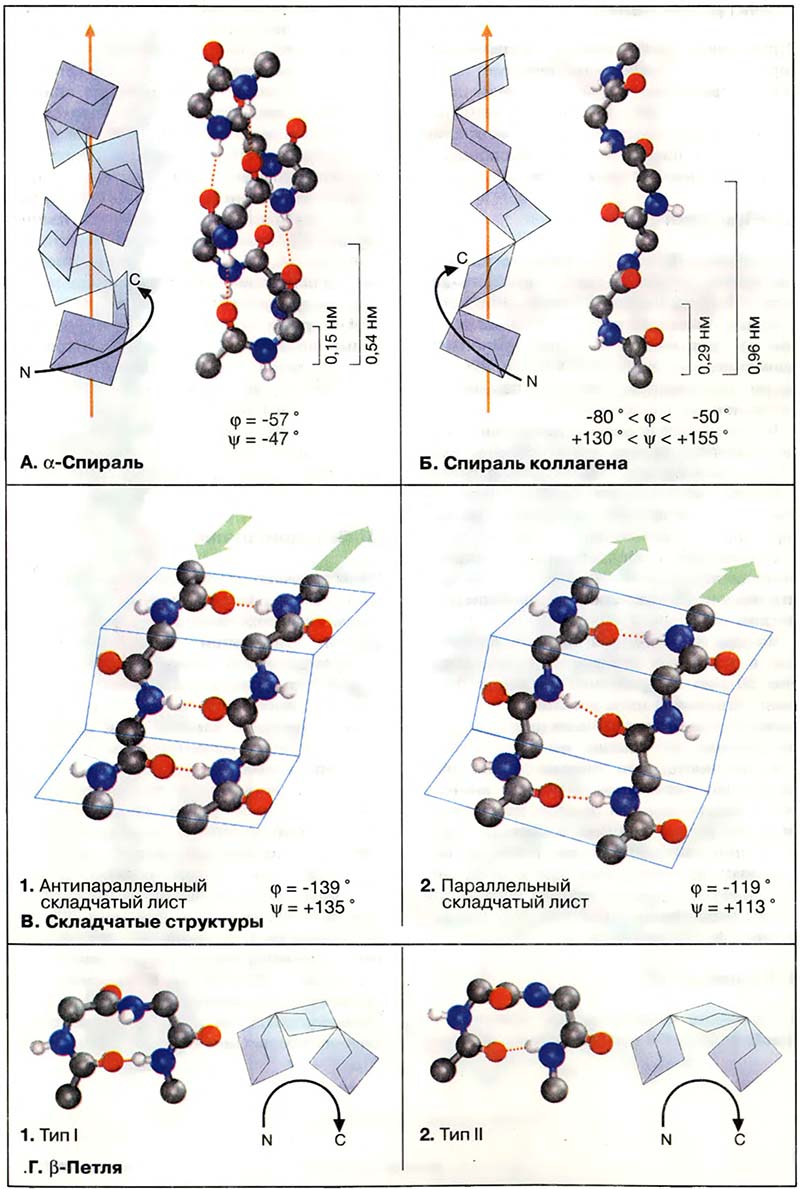
Наиболее распространённым элементом вторичной структуры является правая а-спираль (αR). Пептидная цепь здесь изгибается винтообразно (ось выделена оранжевым цветом). На каждый виток приходится 3,6 аминокислотного остатка, шаг винта (то есть минимальное расстояние между двумя эквивалентными точками) составляет 0,54 нм. α-Спираль стабилизирована почти линейными водородными связями (красный пунктир, см. Кислоты и основания) между NH-группой и CO-группой четвёртого по счету аминокислотного остатка. Таким образом, в протяжённых спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей. Неполярные или амфифильные α-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах (трансмембранные спирали, см. Транспорт газов, Биомембраны: структура и функции).
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Статьи раздела «Вторичные структуры белков»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Молекулярная и клеточная биология (комплект из 3 книг)
Молекулярная и клеточная биология (комплект из 3 книг) В книге известного учёного ФРГ на самом современном уровне обсуждены последние ...
 Молекулярные аспекты жизни
Молекулярные аспекты жизни Два известных американских биохимика в сравнительно небольшой книге подвели ...
 Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries)
Asphaltenes: Chemical Transformation during Hydroprocessing of Heavy Oils (Chemical Industries) During the upgrading of heavy petroleum, asphaltene is the most problematic impurity since it is the main cause of catalyst deactivation and sediments ...