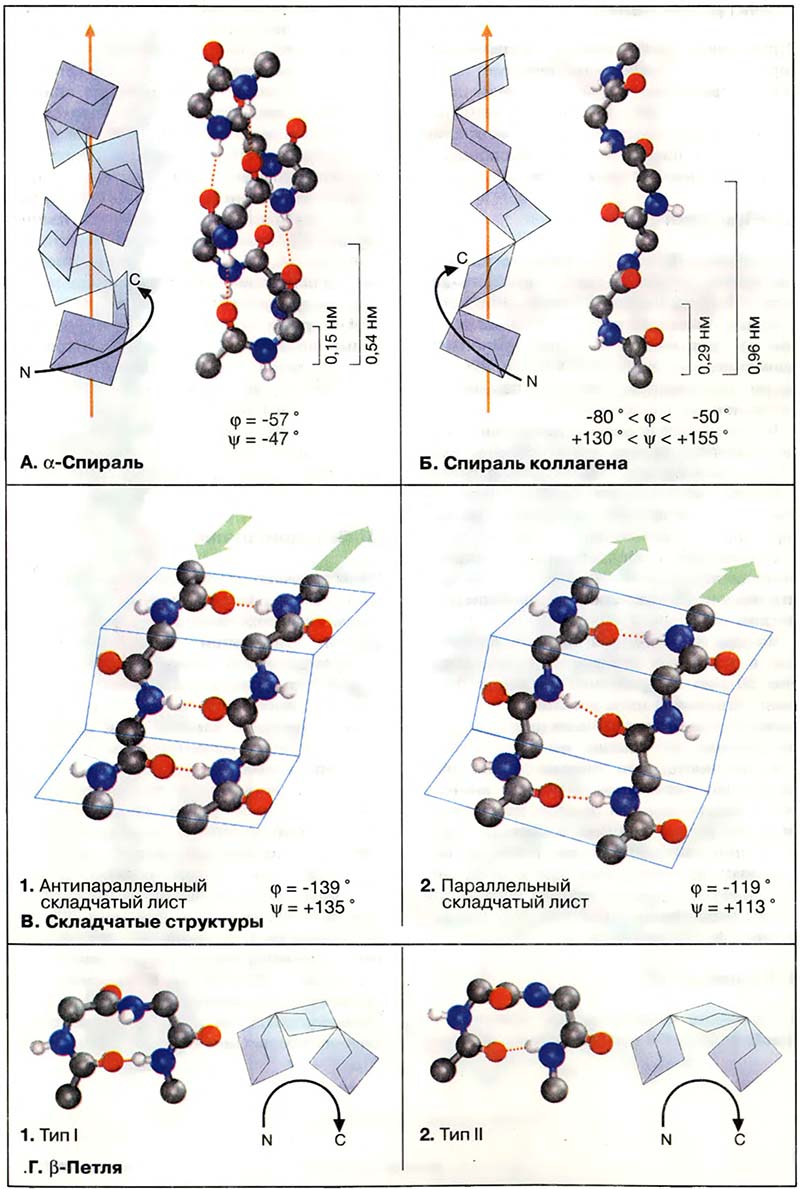
Наиболее распространённым элементом вторичной структуры является правая а-спираль (αR). Пептидная цепь здесь изгибается винтообразно (ось выделена оранжевым цветом). На каждый виток приходится 3,6 аминокислотного остатка, шаг винта (то есть минимальное расстояние между двумя эквивалентными точками) составляет 0,54 нм. α-Спираль стабилизирована почти линейными водородными связями (красный пунктир, см. Кислоты и основания) между NH-группой и CO-группой четвёртого по счету аминокислотного остатка. Таким образом, в протяжённых спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей. Неполярные или амфифильные α-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах (трансмембранные спирали, см. Транспорт газов, Биомембраны: структура и функции).
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
Статьи раздела «Вторичные структуры белков»:
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Микроэлементы в окружающей среде. Биогеохимия, биотехнология и биоремедиация
Микроэлементы в окружающей среде. Биогеохимия, биотехнология и биоремедиация Книга посвящена анализу роли микроэлементов (металлов и металлоидов) в ...
 Внутриклеточная Са2+-зависимая протеолитическая система животных
Внутриклеточная Са2+-зависимая протеолитическая система животных Монография представляет собой обобщающее издание, основанное на анализе ...
 Откровенная наука. Беседы с корифеями биохимии и медицинской химии
Откровенная наука. Беседы с корифеями биохимии и медицинской химии Книга И. Харгиттаи состоит из 36 бесед с выдающимися учёными XX века, работавшими в ...
 The Reef Aquarium: Science, Art, and Technology, Vol. 3
The Reef Aquarium: Science, Art, and Technology, Vol. 3 The Reef Aquarium Volume Three: Science, Art, and Technology Reefkeeping science involves the interplay of biology, chemistry, and physics. However, a ...