Определённые сочетания двугранных углов φ и ψ (см. Гликолиз) встречаются в белках довольно часто. Если множество последовательно связанных аминокислотных остатков принимает стандартные конформации, формируются вторичные структуры, стабилизированные водородными мостиками в пределах одной пептидной цепи или между соседними цепями. Если такая регулярная структура распространяется на достаточно большой фрагмент молекулы белка, такой белок образует механически прочные нити или волокна. Подобного рода структурные белки (см. Структурные белки) имеют характерный аминокислотный состав.
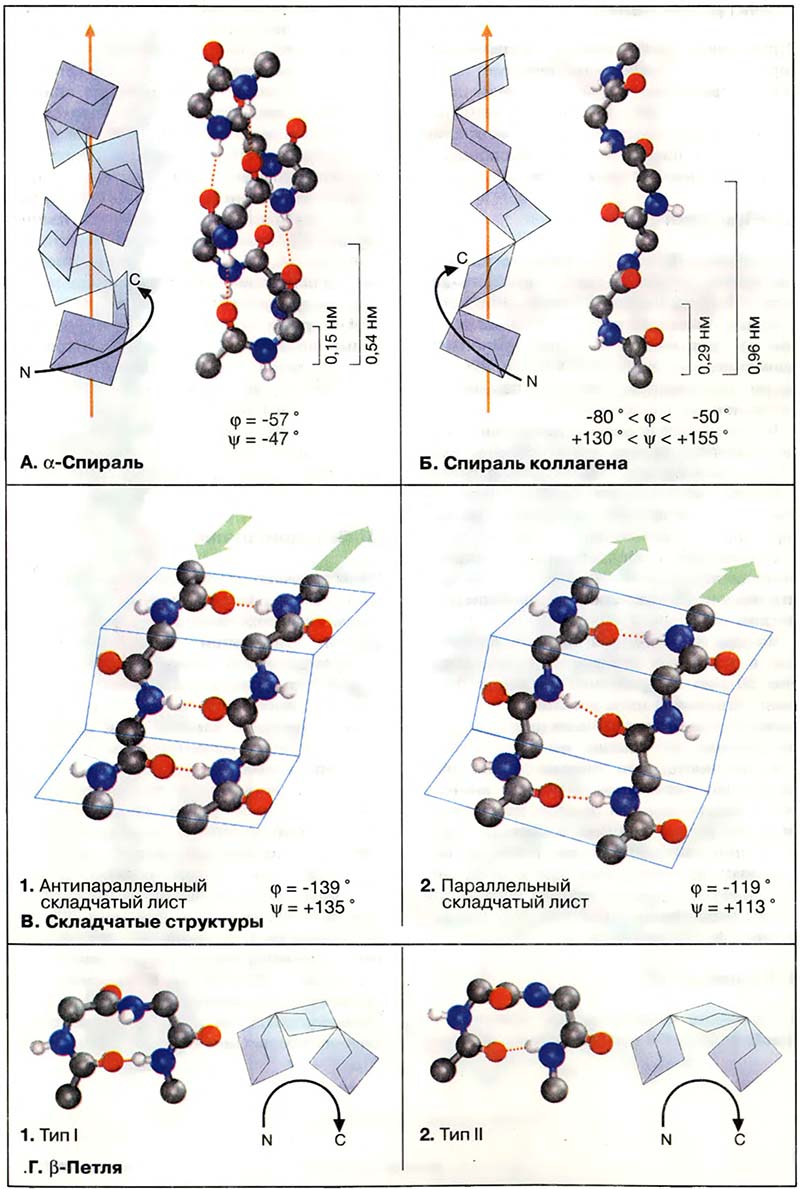
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишённый боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1.
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишённый боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1.
Статьи раздела «Вторичные структуры белков»:
- Вторичные структуры белков
- А. α-Спираль
- Б. Спираль коллагена
- В. Складчатые структуры
- Г. β-Петля
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors
Histone H1 glycation and rutin metabolites as glycation inhibitors: Nuclear protein glycation in vivo and novel natural product AGE inhibitors Protein glycation, induced by hyperglycemia, is implicated in the appearance of diabetic complications and the aging process. Glycation involves the ...
 Cell Biology: With STUDENT CONSULT Online Access
Cell Biology: With STUDENT CONSULT Online Access A masterful, richly illustrated introduction to the cell biology that you need to know.
 Методы в молекулярной биофизике. Структура. Функция. Динамика. В 2 томах. Том 2
Методы в молекулярной биофизике. Структура. Функция. Динамика. В 2 томах. Том 2 Учебное пособие посвящено современному описанию физико-химических подходов, ...
 Фотосинтез. В 2 томах (комплект)
Фотосинтез. В 2 томах (комплект) Книга, написанная в основном американскими авторами, представляет собой ...