Определённые сочетания двугранных углов φ и ψ (см. Гликолиз) встречаются в белках довольно часто. Если множество последовательно связанных аминокислотных остатков принимает стандартные конформации, формируются вторичные структуры, стабилизированные водородными мостиками в пределах одной пептидной цепи или между соседними цепями. Если такая регулярная структура распространяется на достаточно большой фрагмент молекулы белка, такой белок образует механически прочные нити или волокна. Подобного рода структурные белки (см. Структурные белки) имеют характерный аминокислотный состав.
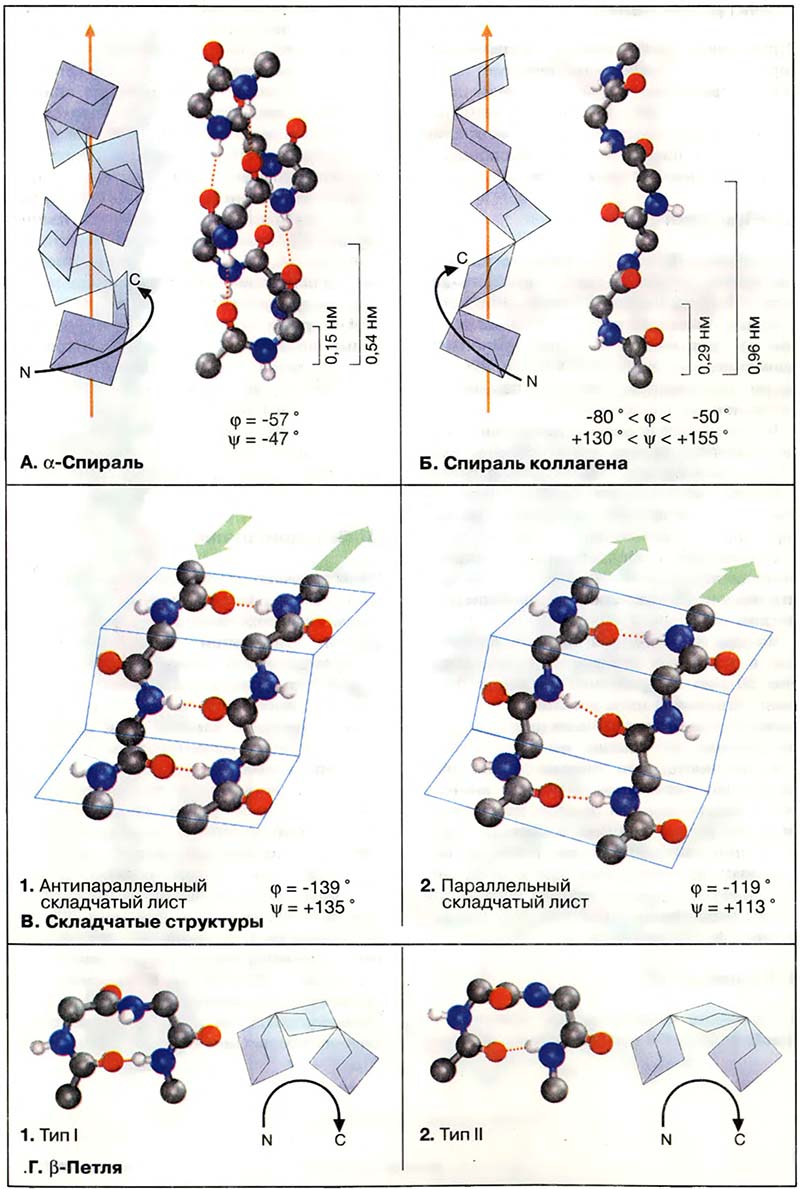
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишённый боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1.
Здесь приведены основные элементы вторичных структур. На рисунках представлен остов полипептидной цепи, лишённый боковых цепей аминокислотных остатков. Для наглядности плоскости пептидных связей изображены в виде голубых пластин. Двугранные углы указанных структур приведены на конформационной карте Г1.
Статьи раздела «Вторичные структуры белков»:
- Вторичные структуры белков
- А. α-Спираль
- Б. Спираль коллагена
- В. Складчатые структуры
- Г. β-Петля
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Geobiology: Objectives, Concepts, Perspectives, First Edition
Geobiology: Objectives, Concepts, Perspectives, First Edition Book DescriptionGeobiology is an exciting and rapidly developing research discipline that opens new perspectives in understanding Earth as a system. ...
Учебник состоит из четырёх частей, включающих 15 глав, в которых изложены вопросы ...
В книге обобщаются современные достижения сравнительно новой отрасли знания, ...
 How to Build a Dinosaur: The New Science of Reverse Evolution
How to Build a Dinosaur: The New Science of Reverse Evolution A world-renowned paleontologist reveals groundbreaking science that trumps science fiction: how to grow a living dinosaur Over a decade after Jurassic ...