Ионообменная хроматография основана на электростатическом взаимодействии между ионами противоположного заряда. Главное условие при этом, чтобы ионы одного заряда были ковалентно фиксированы на инертном носителе. Такой ионообменник будет связывать ионы противоположного заряда. При промывании ионообменника раствором с более высокой ионной силой или иным значением pH сорбированные ионы можно селективно перевести в раствор (элюировать).
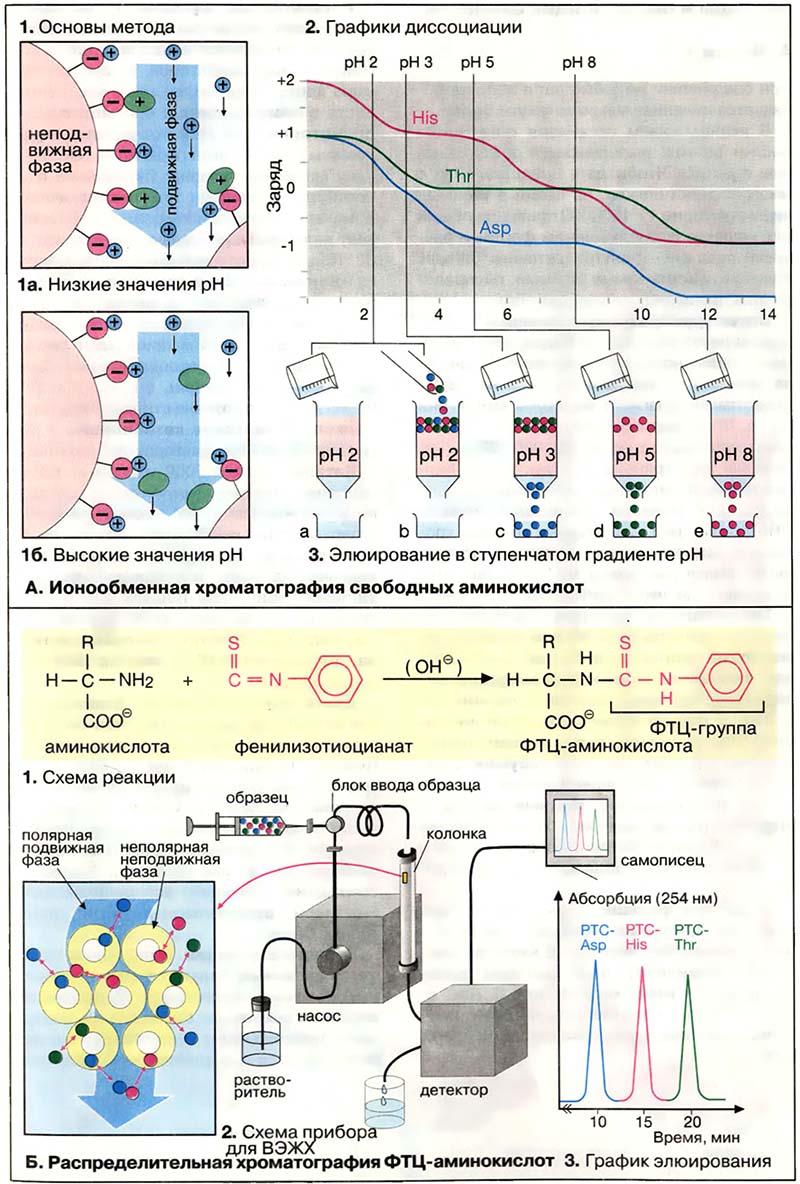
При разделении аминокислот методом ионообменной хроматографии в качестве неподвижной фазы используются гранулы синтетического полимера, несущие сульфогруппы (-SO3-). Эти группы ионизированы во всем диапазоне pH и несут отрицательный заряд. Для подготовки к работе ионообменник помещают в колонку и промывают Na+-содержащим буферным раствором с pH 2. При этом сульфогруппа (красный цвет) связывает ионы натрия (синий цвет). Если теперь нанести на колонку раствор аминокислот (1а), то положительно заряженные аминокислоты (зелёный цвет) вытеснят ионы натрия и будут сорбированы на ионите. Поскольку аминокислоты не несут заряда в изоэлектрической точке, их элюируют с колонки буфером с более высоким значением pH (1б). В качестве примера приведён эксперимент (3) по разделению аспарагиновой кислоты, треонина и гистидина. Графики титрования (2) наглядно объясняют, почему три аминокислоты элюирутся в указанной последовательности.
Строго говоря, аминокислоты элюируются при величинах pH, значительно ниже изоэлектрических точек, поскольку за связывание с ионообменником конкурируют Na+-ионы буферного раствора.
При разделении аминокислот методом ионообменной хроматографии в качестве неподвижной фазы используются гранулы синтетического полимера, несущие сульфогруппы (-SO3-). Эти группы ионизированы во всем диапазоне pH и несут отрицательный заряд. Для подготовки к работе ионообменник помещают в колонку и промывают Na+-содержащим буферным раствором с pH 2. При этом сульфогруппа (красный цвет) связывает ионы натрия (синий цвет). Если теперь нанести на колонку раствор аминокислот (1а), то положительно заряженные аминокислоты (зелёный цвет) вытеснят ионы натрия и будут сорбированы на ионите. Поскольку аминокислоты не несут заряда в изоэлектрической точке, их элюируют с колонки буфером с более высоким значением pH (1б). В качестве примера приведён эксперимент (3) по разделению аспарагиновой кислоты, треонина и гистидина. Графики титрования (2) наглядно объясняют, почему три аминокислоты элюирутся в указанной последовательности.
Строго говоря, аминокислоты элюируются при величинах pH, значительно ниже изоэлектрических точек, поскольку за связывание с ионообменником конкурируют Na+-ионы буферного раствора.
Статьи раздела «Аминокислотный анализ»:
- Аминокислотный анализ
- А. Ионообменная хроматография свободных аминокислот
- Б. Распределительная хроматография ФТЦ-производных аминокислот
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
Учебное пособие освещает систематизированную совокупность современных знаний ...
Книга известного английского биохимика посвящена хемиосмотической теории, ...
В книге даётся богатейший, хорошо систематизированный справочный материал по ...
 Физика белка. Курс лекций с цветными и стереоскопическими иллюстрациями и задачами
Физика белка. Курс лекций с цветными и стереоскопическими иллюстрациями и задачами Физика белка простирается от классификации и принципов устройства белков ...