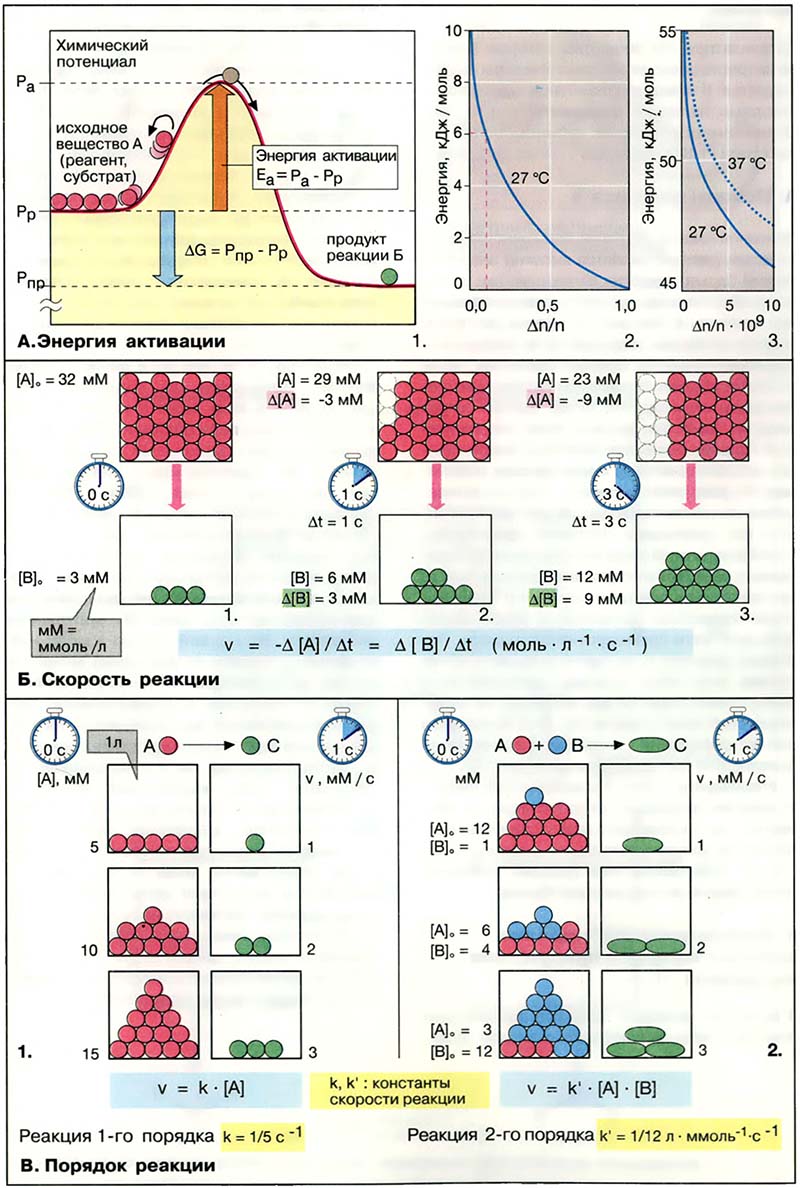
Большинство органических химических реакций (за исключением реакций кислот и оснований, см. Кислоты и основания) протекают очень медленно, независимо от величины ΔG. Главная причина низкой скорости реакции состоит в том, что для вступления в реакцию молекулы реагента должны обладать определённой минимальной энергией, называемой энергией активации. Наглядно это можно представить с помощью энергетической диаграммы наиболее простой реакции A → B (1). Каждое из соединений, реагент A и продукт реакции B, обладает определённым химическим потенциалом (Pр и Pпр соответственно). Изменение свободной энергии реакции (ΔG) соответствует разности потенциалов. Для превращения в B соединение A должно преодолеть энергетический барьер, пик которого Pа выше Pр. Разность потенциалов Pа — Pр носит название энергия активации (Еа).
В пользу того, что A, в принципе, может превратиться в B, свидетельствует то обстоятельство, что Рр является средним значением потенциала для всех молекул, вступающих в реакцию. Время от времени отдельные молекулы достигают гораздо более высокого потенциала, например за счёт столкновения с другими молекулами. Если в результате столкновения энергия молекулы превысит Еa, эта молекула перейдёт энергетический барьер и превратится в B. На рис. 2 и 3 приведено распределение энергии для молекулярных ансамблей, рассчитанное на простой модели. Δn/n это та часть молекул, которая обладает (или превышает) энергией Е (в кДж/моль). Например, при 27 °С около 10 % молекул обладают энергией около 6 кДж/моль. Энергия активации химических реакций обычно существенно выше. Аналогичный график для реакции с энергией активации около 50 кДж/моль приведён на рис. 3. Cтатистически при 27 °С такой энергией обладает только 2 из 109 молекул, при 37 °С — четыре молекулы (3). Подобная зависимость позволяет объяснить найденный эмпирическим путём температурный коэффициент скорости биологических процессов Q10, который означает, что при повышении температуры на 10 °С скорость реакции возрастает в 2 раза.
В пользу того, что A, в принципе, может превратиться в B, свидетельствует то обстоятельство, что Рр является средним значением потенциала для всех молекул, вступающих в реакцию. Время от времени отдельные молекулы достигают гораздо более высокого потенциала, например за счёт столкновения с другими молекулами. Если в результате столкновения энергия молекулы превысит Еa, эта молекула перейдёт энергетический барьер и превратится в B. На рис. 2 и 3 приведено распределение энергии для молекулярных ансамблей, рассчитанное на простой модели. Δn/n это та часть молекул, которая обладает (или превышает) энергией Е (в кДж/моль). Например, при 27 °С около 10 % молекул обладают энергией около 6 кДж/моль. Энергия активации химических реакций обычно существенно выше. Аналогичный график для реакции с энергией активации около 50 кДж/моль приведён на рис. 3. Cтатистически при 27 °С такой энергией обладает только 2 из 109 молекул, при 37 °С — четыре молекулы (3). Подобная зависимость позволяет объяснить найденный эмпирическим путём температурный коэффициент скорости биологических процессов Q10, который означает, что при повышении температуры на 10 °С скорость реакции возрастает в 2 раза.
Статьи раздела «Кинетика химических реакций»:
- Кинетика химических реакций
- А. Энергия активации
- Б. Скорость реакции
- В. Порядок реакции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Книги Список книг
 Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation
Role of TCF in body axis formation: Discovery of a Dual Action of XTCF-3 in Xenopus Body Axis Formation A novel role of TCF family in body axis formation. Revolutionary high impact discoveries are described, elucidating the missing link in the Wnt ...
 Review of Medical Microbiology and Immunology
Review of Medical Microbiology and Immunology To put your preparation for USMLE Step 1 and course exams on the fast track, only one resource will do: «Review of Medical Microbiology and ...
 Молекулярная и клеточная биология (комплект из 3 книг)
Молекулярная и клеточная биология (комплект из 3 книг) В книге известного учёного ФРГ на самом современном уровне обсуждены последние ...
 Биофизическая химия (комплект из 2 книг)
Биофизическая химия (комплект из 2 книг) В трёхтомном издании, написанном учёными из США, на самом современном уровне ...